Anche se i benefici per la salute dei prodotti alimentari a base di latte fermentato sono noti da molto tempo, l’interesse verso i probiotici è decisamente aumentato negli ultimi anni (Thusara RM, 2016).
Lo studio della complessa organizzazione dell’ecosistema intestinale e, in particolare, il legame tra l’equilibrio del microbiota intestinale e diverse patologie umane ha infatti suscitato negli ultimi tempi un notevole interesse da parte dei ricercatori.
È risaputo che l’equilibrio del microbiota intestinale, condizione definita con il termine eubiosi, è molto importante per il benessere dell’organismo. Molte condizioni possono però alterare questo equilibrio determinando una condizione definita disbiosi. Questa perdita di equilibrio determina diversi svantaggi ed è correlabile ad un determinato numero di patologie, sia intestinali, sia extra- intestinali, sia, addirittura, sistemiche.
Pertanto la modulazione del microbiota intestinale come strategia di prevenzione o di supporto nel trattamento di alcune malattie è oggigiorno uno dei campi di ricerca che raccoglie il maggiore interesse. Dati emergenti suggeriscono che la modulazione della flora intestinale con probiotici potrebbe offrire nuove possibilità di profilassi e/o supporto al trattamento per alcune malattie (Thusara RM, 2016), anche in ambito cardiovascolare e metabolico. In particolare, vari studi clinici e sperimentali hanno valutato l’effetto di diversi ceppi probiotici sul controllo dell’ipercolesterolemia.
I probiotici possono essere ingredienti di integratori alimentari e sono costituiti da microrganismi vivi che, se assunti in quantità adeguate, favoriscono l’equilibrio del microbiota intestinale (Linee guida su probiotici e prebiotici. Ministero della Salute, 2013).
5.1. L’ecosistema intestinale e il microbiota intestinale
L’ecosistema intestinale
L’ecosistema intestinale è un sistema molto complesso che svolge numerose funzioni.
È costituito da 2 elementi principali (Figura 2)
a. la BARRIERA INTESTINALE, formata a sua volta, dal punto di vista funzionale, da 3 elementi: la MUCOSA INTESTINALE, il SISTEMA IMMUNITARIO INTESTINALE (o GALT) e il MICROBIOTA INTESTINALE
b. il SISTEMA NERVOSO INTESTINALE (o “SECONDO CERVELLO”)
Figura 2 – ECOSISTEMA INTESTINAL
a. BARRIERA Costituita da:
- MUCOSA INTESTINALE è la più vasta interfaccia di scambio dell’organismo con il mondo esterno, con una superficie che, nell’individuo adulto, misura circa 250-400 m2 (Aureli P et , 2013). Insieme al muco, costituisce la cosiddetta “barriera mucosa”, importante organo di difesa.
- SISTEMA IMMUNITARIO INTESTINALE (GALT), struttura complessa e articolata in grado di far fronte all’imponente quantità di antigeni alimentari e microbici con cui la mucosa viene in Costituisce circa il 70% del sistema immunitario dell’intero organismo.
- MICROBIOTA INTESTINALE chiamato anche microflora intestinale, è composto da un’ampia popolazione microbica (batterica e micotica) che svolge diverse funzioni ed è in grado di influenzare lo stato di salute dell’ospite.
b. SISTEMA NERVOSO INTESTINALE (o “SECONDO CERVELLO”)
parte di sistema nervoso ereditato da forme primordiali e conservato a livello intestinale, collegato strettamente sia con la barriera intestinale che con il primo cervello tramite una doppia via (Gershon MD, 1999; Konturek PC, 2011). Esso produce una serie di mediatori quali quali serotonina (il 90% della produzione totale dell’organismo) e acetilcolina. È costituito da circa 500 milioni di neuroni mentre il cervello ne contiene circa 80 miliardi.
Il microbiota intestinale
Il microbiota intestinale è una struttura talmente complessa che bisognerebbe considerarlo come un vero e proprio metaorgano. È anche la componente della barriera intestinale più dinamica e difficile da indagare.
Il microbiota intestinale è un ecosistema formato da diverse comunità microbiche, in prevalenza batteriche, ma anche micotiche, in equilibrio, costituite da numerose specie e da un’innumerevole quantità di ceppi (Jones BV et al, 2010; Kurokawa K et al, 2007; Gill SR et al, 2006) [1014 unità formanti colonie (UFC), 1.200 specie presenti complessivamente nel genere umano, 400-450 specie nel singolo individuo].
La distribuzione dei microrganismi che compongono il microbiota intestinale non è omogenea lungo l’apparato digerente, come si può osservare in Tabella 7.
Tabella 7 – Distribuzione del microbiota intestinale lungo l’apparato digerente.
|
SEDE |
CELLULE BATTERICHE PER g DI CONTENUTO INTESTINALE |
NOTE |
|
Stomaco, duodeno |
< 103 |
Lattobacilli, Streptococchi HCI, bile e peristalsi inibiscono l’adesione dei batteri e ne ostacolano la colonizzazione |
|
Digiuno, ileo Ileo distale |
102 – 103 104 – 107 |
Scarse informazioni: probabile attività di fermentazione dei carboidrati |
|
Intestino crasso |
1010 – 1012 (prevalenza di anaerobi) |
Sede della maggior parte delle attività del microbiota |
Tabella tratta da: Aureli P et al. Position Paper – Probiotici e salute umana: lo stato dell’arte basato sulle evidenze, 2013.
Il colon rappresenta la sede in cui avviene la maggior parte delle attività del microbiota, ma è anche la zona dove colonizzano le specie potenzialmente più pericolose.
La composizione del microbiota intestinale è variegata e dinamica, cambia da individuo a individuo e, nello stesso individuo, tende a modificarsi nel tempo, malgrado il tentativo di mantenere la microflora intestinale in un equilibro costante.
Il microbiota di ogni individuo è comunque caratteristico, si dice che possieda una propria “impronta digitale batterica”, anche se non costante al 100%; una specie di “carta di identità” che lo differenzia dal microbiota di tutti gli altri individui. Esiste però un “core” costituito da circa 60 specie batteriche comune in tutti gli individui (Aureli et al., 2013).
In generale nel microbiota si possono distinguere tre categorie di microrganismi:
- i microrganismi benefici quali Lactobacilli, Bifidobatteri, Eubacteria, Saccharomyces Boulardii
- i microrganismi indifferenti (i più numerosi, il cui ruolo, seppur ancora poco conosciuto, è importante per mantenere in equilibrio il microbiota) quali Streptococchi, Coli, Bacteroides
- i microrganismi potenzialmente patogeni (normalmente innocui grazie alla presenza degli altri generi di microrganismi) quali Stafilococchi, Clostridi, Proteus, Pseudomonas (Sears Cl, 2005).
Se questi microrganismi sono in equilibrio (condizione che, come abbiamo già detto, viene definita eubiosi) contribuiscono in modo significativo allo stato di salute dell’ospite, sia a livello di protezione da agenti esterni che di attività metaboliche ed enzimatiche.
Tra le numerose funzioni svolte dal microbiota vi sono:
- la protezione da batteri patogeni (partecipazione barriera mucosa)
- la competizione con altre forme microbiche per i nutrienti e per l’adesione alle proteine dell’ospite (collagene, fibrinogeno…)
- la secrezione di batteriocine (sostanze ad attività battericida)
- l’azione favorente la digestione e l’assorbimento di nutrienti
- la fermentazione di carboidrati e la sintesi di acidi grassi a catena corta
- la degradazione di xenobiotici
- la sintesi di vitamine (gruppo B e vitamina K)
- la stimolazione e modulazione del GALT (sistema immunitario intestinale) (Cummings JH et al, 1997; Resta SC, 2008; Tsuji M et al, 2008).
Quando l’equilibrio del microbiota viene perso si parla invece di disbiosi; in questo caso si ha un’alterazione della composizione del microbiota intestinale sia in senso qualitativo che quantitativo con un’eccessiva presenza di forme patogene abituali o di altre forme che normalmente non fanno parte del microbiota, quali Candida albicans, Lamblia, batteri o virus.
Diversi sono gli eventi che possono portare a disbiosi, tra questi riconosciamo cause alimentari, microbiche e iatrogene:
- infezioni e infestazioni
- antibiotico terapia
- immunosoppressori, anticoagulanti orali, inibitori di pompa protonica, corticoterapia prolungata
- dieta incongrua, che modifica il pH, e intolleranze alimentari
- alterazioni della risposta
La disbiosi può essere distinta in disbiosi acuta (es. quella legata all’uso di antibiotici o ad infezioni microbiche acute) e in disbiosi cronica; ma anche in disbiosi carenziale (con riduzione di bifidi e lattici), in disbiosi fermentativa (sostenuta dalla maldigestione dei carboidrati), in disbiosi putrefattiva (quando il problema è a carico delle proteine), da sensibilizzazione (anomala risposta immunitaria verso i componenti fisiologici del microbiota) e in disbiosi micotica (sostenuta dalla Candida, sempre più frequente).
Questa alterazione dell’equilibrio del microbiota ha diversi effetti negativi, tra cui:
- l’aumento di permeabilità della barriera della mucosa
- un netto incremento del passaggio di antigeni sensibilizzanti e germi
- la riduzione della quota di lactobacilli e bifidobatteri produttori di lattasi e di enzimi vari
- una ridotta modulazione del GALT e attivazione del MALT (sistema immunitario associato alle mucose)
- la mancata sintesi di vitamine e acidi grassi a catena
Ma soprattutto, quello che si viene a creare in caso di perdita dell’equilibrio del microbiota intestinale è un’infiammazione silente di basso livello (low grade inflammation) che nel tempo si può diffondere a livello sistemico e avere un ruolo nello sviluppo di diversi stati di malattia (Nagpal R et al, 2016).
Come anticipato, infatti, condizioni di disbiosi sembrano essere correlate non solo a disordini intestinali, ma anche a disordini extra-intestinali (quali la sindrome metabolica, le malattie cardiovascolari e l’obesità) (Thusara, 2016).
Per correggere le disbiosi, i principali tipi di intervento sono tre: la correzione degli errori nella dieta, l’eradicazione dell’eventuale infezione/infestazione e soprattutto il ripristino dell’equilibrio del microbiota intestinale attraverso l’uso appropriato di probiotici.
5.2 I probiotici
La storia dei probiotici ha inizio con il biologo russo Ilya Ilych Metchnikoff (1845-1916) e le sue osservazioni sulla longevità delle popolazioni caucasiche. Tali popolazioni godevano di una vita media piuttosto lunga e Metchnikoff evidenziò la causa nella dieta particolarmente ricca di fermenti lattici (Metchnikoff, 1907).
Il termine “probiotico” (letteralmente “a favore della vita”) fu introdotto per la prima volta nel 1965 da Lilly e Stillwell (Lilly and Stillwell, 1965) e nel tempo ha assunto significati differenti (Tabella 8) (Capurso L, 2015; Morelli L. , 2016).
La definizione di probiotico che viene attualmente riconosciuta a livello internazionale è quella fornita dalla FAO e dall’OMS nel 2001 (FAO/OMS, 2001): “Live microorganisms which when administered in adequate amounts confer a health benefit on the host”.
E nel 2005 anche il Ministero della Salute ha fornito una definizione relativa ai probiotici in linea con tale definizione: “Microrganismi vivi che si dimostrano in grado, una volta ingeriti in adeguate quantità, di esercitare funzioni benefiche per l’organismo”.
I prebiotici sono invece fibre alimentari insolubili che, quando somministrate in quantità adeguata, favoriscono selettivamente la crescita l’attività di uno o più batteri già presenti nel tratto gastrointestinale o assunti contestualmente al prebiotico.
Tabella 8 – Le definizioni di “probiotico”.
|
DEFINIZIONE |
AUTORI |
REFERENZA |
|
Sostanze che prolungano la fase logaritmica di crescita in altre specie microbiche |
Lilly DM, Stillwell RH, 1965 |
Probiotics: growth promoting factors produced by microorganisms. Science 1965; 147:747-8 |
|
Microrganismo vivente che esercita un effetto positivo sulla salute dell’ospite con il risultato di rafforzare l’ecosistema intestinale |
Fuller R, 1989 |
Probiotics in man and animals. J Appl Bacteriol 1989; 66(5):365-78 |
|
Organismi vivi che, consumati in quantità adeguata, conferiscono un beneficio all’ospite |
Guamer F, Schaafsma GJ, 1998 |
|
|
Organismi vivi che, somministrati in quantità adeguata, apportano un beneficio alla salute all’ospite |
FAO/OMS, 2001 |
http://www.fao.org/ag/agn/agns/ micro_ probiotics _ en.asp |
|
Microrganismi vivi e vitali che conferiscono benefici alla salute dell’ospite quando consumati, in adeguate quantità, come parte di un alimento o di un integratore |
Ministero della Salute, 2005, aggiornamento 2013 |
http://www.salute.gov.it/imgs/C_ 17_ pubblicazioni_ 1016_ allegato.pdf |
Tabella tratta da Morelli L. Integratori con probiotici. Review Scientifica sull’Integrazione Alimentare: stato dell’arte alla luce delle evidenze scientifiche. Edra, 2016.
Come sottolineato nella recente Review Scientifica sull’Integrazione Alimentare, realizzata per INTEGRATORI ITALIA – AIIPA (Review Scientifica sull’Integrazione Alimentare: stato dell’arte alla luce delle evidenze scientifiche. Edra, 2016), analizzando le definizioni date al termine probiotico nel tempo (Tabella 8) si può osservare come da una definizione iniziale più vicina alle cosiddette sostanze ad azione prebiotica, si è andati verso una definizione incentrata maggiormente sui microrganismi (necessariamente vivi e vitali), consumati in adeguata quantità.
Oggi si possono quindi identificare per i probiotici le seguenti caratteristiche:
- i microrganismi devono essere vivi e vitali al momento dell’uso
- per essere efficaci devono essere consumati in adeguata quantità
- il loro utilizzo deve associarsi a benefici per la
Come anticipato, l’interesse verso i probiotici è notevolmente aumentato, anche da parte dei ricercatori.
I benefici dei probiotici riportati in letteratura (World Gastroenterology Organisation, 2011) sono molteplici e, in relazione alla già citata complessità dell’ecosistema intestinale, interessano non soltanto patologie dell’apparato digerente ma anche malattie a livello sistemico.
Tra le patologie correlabili all’alterazione del microbiota intestinale e che possono beneficiare dell’assunzione di probiotici, vi sono:
- la diarrea da antibiotico terapia, anche da difficile (Szymansky H et al, 2006)
- le diarree microbiche (rotavirus) (Oberhelman R et al, 1999)
- la leaky gut syndrome (o sindrome da alterata permeabilità intestinale)
- la sindrome da intestino irritabile (IBS)
- la dispepsia
- le coliti infiammatorie (IBD)
- le gastriti da Helicobacter pylori ma anche:
- le flogosi recidivanti delle prime vie aeree e delle vie urinarie (Zuccotti GV et al, 2008)
- l’atopia: eczema (Meneghin F et al, 2012
- le candidosi vaginali ricorrenti
- alcune alterazioni metaboliche (es. l’ipercolesterolemia) (Thushara RM, 2016).
In questo contesto occorre sottolineare come gli effetti dei probiotici siano “ceppo specifici”, ovvero non si possono trasferire ad altri microrganismi della stessa specie o dello stesso genere.
Concludendo, possiamo ricordare le caratteristiche fondamentali che deve avere un probiotico:
- provenienza intestinale umana
- precisa classificazione tassonomica
- assenza di patogenicità o tossicità
- assenza di antibiotico-resistenza trasmissibile
- resistenza ai succhi gastrici e ai sali biliari
- adesione alle cellule epiteliali intestinali e colonizzazione
- produzione di sostanze in grado di contrastare i patogeni
- vitalità durante il periodo di conservazione
- adeguata quantità di Unità Formanti Colonie (UFC).
Esistono anche alcune criticità. Bisogna infatti tener presente che il probiotico è un integratore alimentare con caratteristiche uniche: non è una molecola bensì un microrganismo vivente che deve rimanere tale lungo tutta la filiera produttiva, il periodo di shelf life e giungere ancora vitale nell’intestino dopo la sua assunzione.
La maggior parte dei probiotici vengono normalmente liofilizzati per la conservazione e per garantire la loro sopravvivenza fino alla scadenza del prodotto. Il contatto con l’acqua, sotto forma di umidità nelle sue diverse forme, riattiva il ciclo biologico dei microrganismi riducendone notevolmente la sopravvivenza. Anche il contatto con l’ossigeno procura danni notevoli per la conservazione e la vitalità, per questo, sia durante la produzione sia durante la conservazione, é utilizzato l’azoto al fine di ovviare a questo problema. Un altro elemento fondamentale è il controllo della temperatura, che non deve superare i 25°C.
Probiotici e EFSA (European Food Safety Authority)
Per molte categorie di nutraceutici non esistono, ad oggi, claims specifici autorizzati dall’EFSA, organismo europeo sovranazionale, in rapporto ad indicazioni selettive.
Anche per quanto riguarda i probiotici, tutt’oggi manca un claim specifico relativo ai potenziali benefici sui livelli in eccesso di colesterolo, in quanto studi multicentrici specifici e dedicati non sono ancora terminati o si trovano tuttora in fase iniziale.
Occorre pertanto considerare, in generale, che il cosiddetto claim può essere definito ed approvato anche, e soprattutto, in una fase di “maturità” dello specifico nutraceutico. Questo anche in virtù del fatto che, agli integratori alimentari, si applicano molte normative comunitarie in materia di sicurezza dei prodotti e di informazione ai consumatori, armonizzate a livello dell’Unione Europea (UE), ma si applica anche una normativa nazionale specifica, diversa da Paese a Paese.
In alcuni casi, a seconda dello specifico Stato nazionale, si è creata un’elevata eterogeneità per alcune categorie di integratori che rende difficile assegnare claims validi per tutti i Paesi dell’UE e questo costituisce un ulteriore fattore di complicazione che contribuisce a creare tempi d’attesa (per i claim) molto lunghi.
Tornando nello specifico ai probiotici, l’EFSA ha comunque fornito alcune indicazioni riguardanti:
- i criteri per lo status di Presunzione Qualificata di Sicurezza (QPS) per i ceppi probiotici: assenza di resistenza trasmissibile agli antibiotici ad uso umano e veterinario e assenza di virulenza (EFSA, 2011)
- la quantità minima di UFC di probiotico contenuto negli integratori alimentari, stabilendo che debba essere pari almeno ad 1 miliardo di UFC, per dose giornaliera, per almeno 1
5.3 Evidenze su efficacia e sicurezza dei probiotici nel mantenimento di una colesterolemia normale
Come già sottolineato, le condizioni del microbiota intestinale hanno un impatto significativo sulla salute dell’uomo. Recenti evidenze, in particolare, hanno suggerito che una perdita di equilibrio di questo sistema può associarsi alla presenza di patologie cardiovascolari e metaboliche sistemiche (Yoo JY et al, 2016). Inoltre, diversi studi hanno indagato la possibilità di modulare, per mezzo di probiotici, la microflora intestinale quale target per la prevenzione delle malattie cardiovascolari (Thushara RM et al, 2016).
In ambito cardiovascolare e metabolico, si pensa che i probiotici possano intervenire in modo favorevole a diversi livelli: agendo sull’ipercolesterolemia, sull’ipertensione arteriosa, sul diabete mellito di tipo 2 e sull’obesità (Figura 3).
Figura 3 – Rappresentazione schematica dei fattori di rischio cardiovascolari e dei possibili microrganismi probiotici che potrebbero ridurre il rischio per ciascun fattori
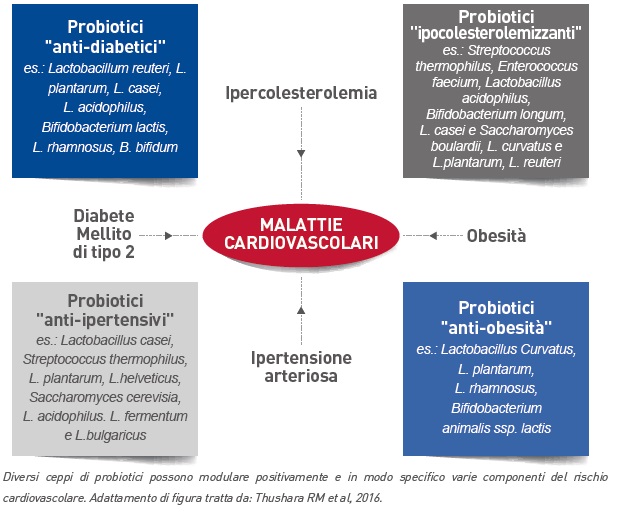
Studi clinici con probiotici in soggetti con colesterolemia normale o moderatamente elevata
Vari studi clinici e sperimentali hanno valutato l’effetto di vari ceppi probiotici sui livelli di colesterolemia.
Studi sperimentali in modelli animali hanno dimostrato, ad esempio, l’efficacia di diversi batteri lattici, tra cui il Bifidobacterium Longum BB536, nella riduzione dei livelli di colesterolemia (Al-Sheraji SH et al, 2015).
La sperimentazione clinica dei probiotici, in questo ambito, comprende ad oggi una serie di studi, anche di buona qualità (studi randomizzati, doppio cieco, controllati con placebo), che hanno valutato l’effetto sul profilo lipidico di uno o più ceppi probiotici, prevalentemente inseriti in una matrice alimentare (latte fermentato oyogurt in quantità totale di 300-400 ml/die), a volte anche in associazione con prebiotici in soggetti con colesterolemia nella norma o moderatamente elevata. La durata dell’intervento era tra le 3 e le 8 settimane (Agerholm-Larsen L et al, 2000), se si esclude uno studio a lungo termine (6 mesi) (Kiessling G et al, 2002).
Da notare come spesso l’entità della riduzione della colesterolemia totale e del C-LDL sia proporzionale ai valori di base, quindi con una maggiore riduzione percentuale nei soggetti con valori relativamente elevati di colesterolemia, rispetto ai soggetti normocolesterolemici (effetto “baseline”).
In sintesi, i risultati degli studi clinici con probiotici (a volte in associazione con prebiotici) sono piuttosto variabili:
- colesterolo totale: riduzione 0 – 5,4%
- C-LDL: riduzione 0 – 8,4/16%
- C-HDL: invariato o aumentato
Da notare, inoltre, come spesso l’assenza di riduzione di colesterolo totale e C-LDL veniva osservata soprattutto quando venivano studiati soggetti con colesterolemia basale normale (Schaafsma G et al, 1998; Kiessling G et al, 2002; Sadrzadeh-Yeganeh H et al, 2010).
In uno studio clinico in donne con colesterolemia normale o moderatamente elevata, che ha usato come trattamento attivo latte fermentato con Lactobacillus acidophilus e Bifidobacterium longum BB536, il C-LDL si è ridotto del 16% solo nelle donne con ipercolesterolemia (Andrade S, et al 2009).
Una recente metanalisi (Shimizu M et al, 2015), basata su 8-11 studi (in base ai biomarcatori valutati), ha concluso che l’assunzione di probiotici specifici ha un effetto vantaggioso per la colesterolemia totale e il C-LDL, un effetto neutro per il C-HDL e i trigliceridi e un effetto differente in relazione ai vari ceppi utilizzati.
Meccanismi d’azione
Per quanto riguarda l’effetto ipocolesterolemizzante dei probiotici, è possibile individuare almeno tre principali meccanismi d’azione (Thushara RM et al, 2016):
- l’effetto sul metabolismo dei sali biliari [deconiugazione da parte della idrolasi per i sali biliari (BSH, bile-salt hydrolase)]
- la produzione di acidi grassi a corta catena (SCFA, short chain fatty acids)
- l’assimilazione del colesterolo da parte della membrana cellulare
La deconiugazione enzimatica degli acidi biliari da parte della BSH è stata proposta come un importante meccanismo molecolare efficace nella riduzione della colesterolemia (Yoo JY et al, 2016) (Figura 4).
La bile è composta da acidi biliari coniugati, colesterolo, fosfolipidi, pigmento biliare ed elettroliti. È sintetizzata nel fegato ed è conservata a concentrazioni elevate nella cistifellea. Dopo l’assunzione di cibo essa viene rilasciata nel duodeno. La bile funziona come un detergente biologico che emulsiona e solubilizza i lipidi per la digestione. La BSH catalizza l’idrolisi degli acidi biliari primari coniugati alla glicina o alla taurina, generando acidi biliari non coniugati, che sono meno solubili e riassorbiti in modo meno efficiente rispetto ai coniugati, e sono eliminati con le feci. La deconiugazione dei sali biliari può portare a una riduzione della colesterolemia, sia aumentando l’utilizzo del colesterolo per la sintesi de novo di acidi biliari, per sostituire quelli eliminati con le feci, sia riducendo la solubilità del colesterolo stesso e, quindi, il suo assorbimento nel lume intestinale.
Figura 4 – Effetto della BSH dei probiotici nella riduzione della colesterolemia

Per quanto riguarda l’azione degli acidi grassi a corta catena prodotti dal microbiota intestinale, si pensa che il loro aumentato afflusso al fegato possa portare a un miglioramento di sintesi dei trigliceridi e a una diminuzione della espressione intestinale di angiopoietin-like 4 (ANGPTL4), che è anche un inibitore della lipasi lipoproteica, che a sua volta promuove la rimozione dei lipidi.
Prospettive future
Gli studi clinici sinora condotti con probiotici per il controllo della colesterolemia confermano la possibilità di controllare almeno in parte livelli moderatamente elevati di colesterolemia, anche se presentano alcune criticità che potranno essere affrontate in studi clinici futuri:
- l’utilizzo di quantità piuttosto elevate di yogurt o latte fermentato (300-450 g/die) (aspetto poco riproducibile nella vita reale)
- l’utilizzo concomitante, in alcuni studi, di prebiotici, aspetto che li rende poco comparabili con gli studi utilizzanti solo probiotici
- l’arruolamento anche di soggetti con livelli nella norma di colesterolo (quindi di soggetti generalmente a basso rischio, con un effetto, di conseguenza, meno evidente o nullo per il cosiddetto “effetto baseline”, secondo cui più alto è il colesterolo al basale, più elevato sarà l’effetto del principio attivo somministrato).
- la durata spesso limitata dell’intervento nutraceutico
- la valutazione della interazione tra probiotici e microbiota intestinale del
Vari studi clinici sono attualmente in corso a livello mondiale e il sito “https://clinicaltrials.gov”, che riporta tutti gli studi registrati, permette di evidenziarne almeno una ventina. Tra questi appare interessante anche uno studio su “Efficacy of a Red Yeast Rice Based Nutraceutical Plus Probiotic in Patients With Moderate Hypercholesterolemia”, che valuta gli effetti della associazione di un ceppo probiotico (Bifidobacterium longum BB536®) ad altre componenti nutraceutiche (riso rosso fermentato, niacina e coenzima Q10), in una forma farmaceutica (granulare solubile), contenuta in una busta suddivisa in due camere che consente al probiotico di non interagire con gli altri componenti. Ci si attende che studi di qualità, condotti con probiotici preparati in forme farmaceutiche, possano permettere di superare i limiti intrinseci dell’uso di matrici alimentari (latte fermentato, yogurt), poco utilizzabili in grande quantità nella vita reale, fornendo solide informazioni sulla sicurezza e sull’efficacia dei probiotici nel controllo della colesterolemia.
5.2 Associazione di probiotici e altri nutraceutici per il controllo dei livelli circolanti di colesterolo: razionale e prospettive
L’effetto sui livelli circolanti di colesterolo riportato dalle evidenze scientifiche per alcuni nutraceutici ha destato un considerevole interesse, stimolando lo sviluppo di preparati contenenti più composti attivi al fine di ottenere un maggiore effetto di riduzione della colesterolemia, soprattutto dei livelli di C-LDL (Position Statement SID-SISA, 2016).
Oltre che dalla possibilità di sfruttare eventuali effetti complementari dei singoli nutraceutici, l’ipotesi di utilizzare combinazioni di più nutraceutici nasce anche dall’esigenza di impiegare i nutraceutici alle dosi più basse possibili per cercare di mantenere l’efficacia garantendo la migliore tollerabilità (Position Statement SID-SISA, 2016).
Al riguardo, grazie ancheavaristudirandomizzatiecontrollati, lavalidità dei nutraceutici di combinazione nel settore delle dislipidemie è un dato consolidato. In generale, si osserva un effetto additivo dei composti associati in preparazioni nutraceutiche, mentre, ad oggi, non vi sono osservazioni che indichino un effetto sinergico in termini di efficacia ipocolesterolemizzante.
In conclusione, appare importante sottolineare come i prodotti nutraceutici di combinazione, se contengono un numero limitato di composti attivi, con efficacia comprovata e che agiscono tramite meccanismi diversi tra loro, rappresentino un approccio moderno e razionale nell’ambito della prevenzione cardiometabolica in pazienti a rischio lieve-moderato






