L’uso di integratori e molto comune in uomini che richiedono una consulenza andrologica per motivi di salute riproduttiva, sessuale e/o prostatica. Molteplici formulazioni sono in commercio o reperibili attraverso il web, e contengono numerosi componenti combinati, la cui purezza e titolazione non sono tuttora soggette a regolamentazione. In questo breve commento, ci limiteremo ad illustrare i componenti utilizzati maggiormente dalle aziende, in modo da fornire al lettore una visione di insieme sulle possibilita terapeutiche di queste sostanze. Poiche i rimedi naturali possono rappresentare la prima scelta del paziente con problematiche uro-andrologiche, e bene che i medici siano a conoscenza delle indicazioni e della sicurezza che tali sostanze mostrano negli studi clinici, in modo da poter meglio consigliare i propri pazienti.
Nutraceutica e fertilità
Stress ossidativo e fertilità maschile
Lo stress ossidativo (OS) rappresenta una delle cause piu importanti di infertilita maschile. Infatti, e stato riportato che gli uomini infertili hanno ridotti livelli di antiossidanti nel loro liquido seminale rispetto agli uomini fertili [1], mentre i livelli di radicali liberi dell’ossigeno (ROS) sono aumentati [2]. In considerazione del gran numero di fattori in grado di causare un aumento dello OS e quindi di danneggiare la spermatogenesi e la funzione nemaspermica, numerosi prodotti “nutraceutici” ad attivita antiossidante sono largamente impiegati nei pazienti con infertilita.
Gli antiossidanti
Le principali sostanze ad azione antiossidante che sono comunemente utilizzate comprendono:
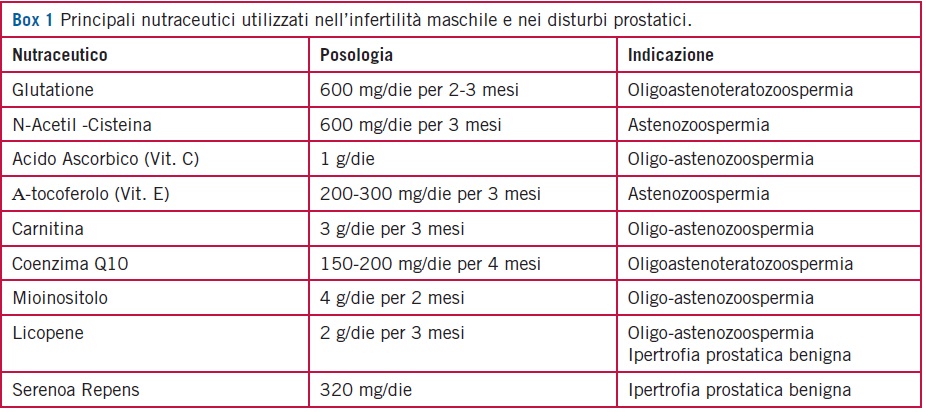
- Il glutatione (GSH). Si concentra nel liquido seminale dove protegge gli spermatozoi dallo OS, in particolar modo durante i processi infiammatori. Infatti, la sua supplementazione negli uomini infertili con varicocele o flogosi del tratto urogenitale migliora significativamente la concentrazione, la motilita e la morfologia spermatica [3]. Una riduzione del GSH nel liquido seminale umano determina una riduzione della motilita [4]. Il dosaggio prevede la somministrazione di 600 mg/die i.m. per 2-3 mesi.
- La N-Acetil-Cisteina (NAC). E il precursore del glutatione e sembra migliorare la motilita spermatica e prevenire il danno ossidativo del DNA [5]. Inoltre migliora significativamente il volume e la viscosita del liquido seminale [6]. Il piu comune dosaggio orale utilizzato e 600 mg/die.
- L’acido ascorbico (Vit. C). E un potente antiossidante quando il radicale perossile e presente nella fase acquosa. La sua concentrazione nel liquido seminale e 10 volte superiore rispetto al plasma [7]. La sua somministrazione correla positivamente con la conta spermatica e la motilita [8] e negativamente con l’indice di frammentazione del DNA [9]. E tuttavia importante ricordare che, ad alte concentrazioni, la Vit. C puo invece attivare un processo di auto-ossidazione [10].
- L’a-tocoferolo (Vit. E). La somministrazione di Vit. E riduce significativamente la concentrazione di malonildialdeide (MDA) (un prodotto stabile dell’ossidazione degli acidi grassi della membrana citoplasmatica) e aumenta la motilita spermatica in soggetti astenozoospermici [11].
- La carnitina. Attualmente e la molecola con attivita antiossidante con maggiore consenso in letteratura, specialmente nelle sue forme di L-carnitina e L-acetilcarnitina. Le concentrazioni nel tratto riproduttivo maschile, soprattutto a livello epididimario, sono particolarmente alte, cio suggerisce il suo ruolo cruciale nel metabolismo energetico e nella maturazione spermatica [12, 13]. La sua somministrazione ha mostrato la capacita di migliorare la concentrazione, la conta nemaspermica totale e la motilita progressiva nei soggetti con oligo-astenoteratozoospermia (OAT) [14-17]. Il migliore schema terapeutico e rappresentato dalla co-somministrazione di almeno 2 g/die di L-carnitina e 1 g/die di acetil-Lcarnitina per almeno 3 mesi.
- Il coenzima Q10. Agisce nella sua forma ridotta (ubiquinolo) inibendo la formazione di idroperossido nel fluido seminale e migliorando la conta spermatica, la motilita e la morfologia in pazienti con OAT idiopatica [18, 19] e con varicocele [20].
- Il mioinositolo (MYO). Regola l’osmolarita plasmatica seminale, l’espressione delle proteine essenziali per lo sviluppo embriogenetico, per la chemiotassi e la motilita spermatica. Inoltre, e coinvolto nella capacitazione spermatica e nella reazione acrosomiale. L’incubazione con MYO migliora la motilita spermatica progressiva e totale, la funzione mitocondriale in pazienti con OAT e aumenta il numero di spermatozoi recuperati dopo tecnica swim-up [21]. La strategia terapeutica piu frequente prevede la somministrazione orale giornaliera di 4 g (piu 400 μg di acido folico) per almeno 2 mesi.
- Licopene. Nonostante pochi studi abbiano investigato gli effetti sui parametri spermatici, il licopene rientra tra le scelte terapeutiche dell’infertilita idiopatica [22].
Nel Box 1 vengono riportati i principali nutraceutici utilizzati nel campo dell’infertilita maschile.
Efficacia del trattamento con antiossidanti: studi di metanalisi
Numerosi studi hanno provato che l’impiego di sostanze antiossidanti sia in-vitro che in-vivo porta ad un miglioramento di numerosi parametri spermatici, in modo particolare dopo una attenta diagnosi volta alla eliminazione di tutte le noxae pro-ossidanti. Una metanalisi [23], che ha raccolto i dati ottenuti da 34 studi clinici randomizzati (8 prodotti da gruppi di ricerca italiani), ha valutato gli effetti della supplementazione con antiossidanti sulla fertilita maschile su un totale di circa 2900 coppie, arruolate in 19 diversi Paesi. Si tratta di trial clinici in cui i partner maschili di coppie infertili sono stati randomizzati per la somministrazione, o meno, di sostanze antiossidanti; in alcuni di questi studi sono state incluse coppie sottoposte a cicli di procreazione medicalmente assistita (PMA).
Sono stati eseguiti tre tipi di confronto: antiossidanti versus placebo; antiossidanti versus nessun trattamento; antiossidanti versus antiossidanti (di altra formulazione). Le sostanze antiossidanti somministrate sono state: Vit. E, Vit. C, Vit. B, L-acetilcarnitina, L-carnitina, pentossifillina, magnesio, zinco, etil-cisteina, N-acetilcisteina, acido docosaesaenoico, selenio, oppure varie combinazioni di esse. Da notare che, come spesso accade, alcuni studi hanno analizzato outcome differenti. Il dato piu interessante riguarda il tasso di bambini nati per coppia, in cui il partner maschile era stato trattato, o meno, con antiossidanti: in questo caso, la metanalisi riporta tre studi randomizzati. Il risultato complessivo evidenzia un vantaggio significativo nell’assunzione di antiossidanti, che si traduce in una probabilita quintuplicata di ottenere un figlio (OR 4,85; IC 95% 1,92-12,24; p=0,0008). Piu spesso i trial clinici riportano come outcome principale il tasso di gravidanza per coppia. Per questo dato sono stati analizzati 15 studi e quasi 1000 coppie. Il tasso di gravidanza nelle coppie in cui il partner maschile avesse ricevuto il trattamento con antiossidanti si e rivelato significativamente superiore a quello dei controlli: 16% vs 3% (OR 4,18; IC 95% 2,65-6,59; p<0,00001). Analizzando separatamente i due studi in cui le coppie sono state sottoposte a PMA, i risultati non cambiano ed e evidente un notevole aumento del tasso di gravidanza a seguito della somministrazione di antiossidanti. Riguardo ai possibili e presunti effetti collaterali, nessuno studio ha evidenziato un aumento di sintomi gastrointestinali o d’incidenza di euforia nei soggetti trattati con antiossidanti rispetto al placebo.
Conclusione
In conclusione, la supplementazione con antiossidanti nei maschi infertili puo migliorare i parametri spermatici e gli outcome relativi al tasso di gravidanza e di nati vivi delle coppie sottoposte a PMA. Per tale motivo, nel percorso terapeutico dell’infertilita dovrebbe essere preso sempre piu in considerazione l’utilizzo di queste molecole, sia in-vivo che in-vitro, per il raggiungimento di una migliore “qualita! nemaspermica, per fronteggiare gli effetti negativi dell’aumentato OS e per aumentare il numero totale di spermatozoi recuperati mediante le tecniche di separazione.
Nutraceutica e sessualità
L’uso di sostanze naturali per aumentare le prestazioni sessuali e un fenomeno in crescita negli ultimi anni, soprattutto dopo la commercializzazione degli inibitori della fosfosdiesterasi tipo 5 (PDE5i) [24]. Generalmente i prodotti definiti “naturali” e “sicuri i cui effetti sinergici sul paziente possono risultare dannosi [25]. E stato calcolato che in Europa si vendono attraverso Internet (e-Commerce) sei milioni di pezzi all’anno, questo” spesso contengono sostanze proibite ovvero non dichiarate (come gli stessi PDE5i) ed per una serie di motivi che inducono il paziente a saltare la consultazione medica [26]. Gli effetti collaterali, spesso a carico del sistema nervoso centrale (alterazioni tono dell’umore, ansia/depressione, mania, allucinazioni e dipendenza) si possono verificare con estrema frequenza e sono spesso determinati dalla presenza di sostanze contaminanti ovvero da interazioni tra componenti noti e non noti. Si stima che meno del 1% di tali eventi viene registrato dagli enti regolatori preposti. Inoltre, molti pazienti che acquistano su Internet o direttamente in farmacia senza consultazione medica sono spesso affetti da disordini psichiatrici minori non diagnosticati o assumono farmaci concomitanti di cui e difficile valutare le interazioni farmacologiche senza ausilio medico.
Non meno importante, esistono delle condizioni para-fisiologiche (invecchiamento ad esempio) dove si verifica spesso una diminuzione del desiderio sessuale (dovuta a fisiologica riduzione dei livelli circolanti di testosterone) e disturbi sessuali associati ad insoddisfazione nel rapporto di coppia. E stato oramai chiarito come gli effetti della riduzione di androgeni nei modelli animali determinino numerose alterazioni a livello del tessuto penieno.
Tra questi, i piu importanti sono:
1) degenerazione delle cellule muscolari lisce, apoptosi ed accumulo di adipociti con conseguente fibrosi;
2) riduzione della espressione della nitrossido sintetasi neuronale ed endoteliale;
3) riduzione dell’afflusso arterioso ed aumento del deflusso venoso;
4) aumento della risposta ai mediatori vasocostrittori;
5) riduzione della espressione della PDE5. Quest’ultimo aspetto, confermato anche da successivi studi effettuati nell’uomo, costituisce la base fisiopatologica della mancata risposta ai farmaci orali attivi per la disfunzione erettile [27].
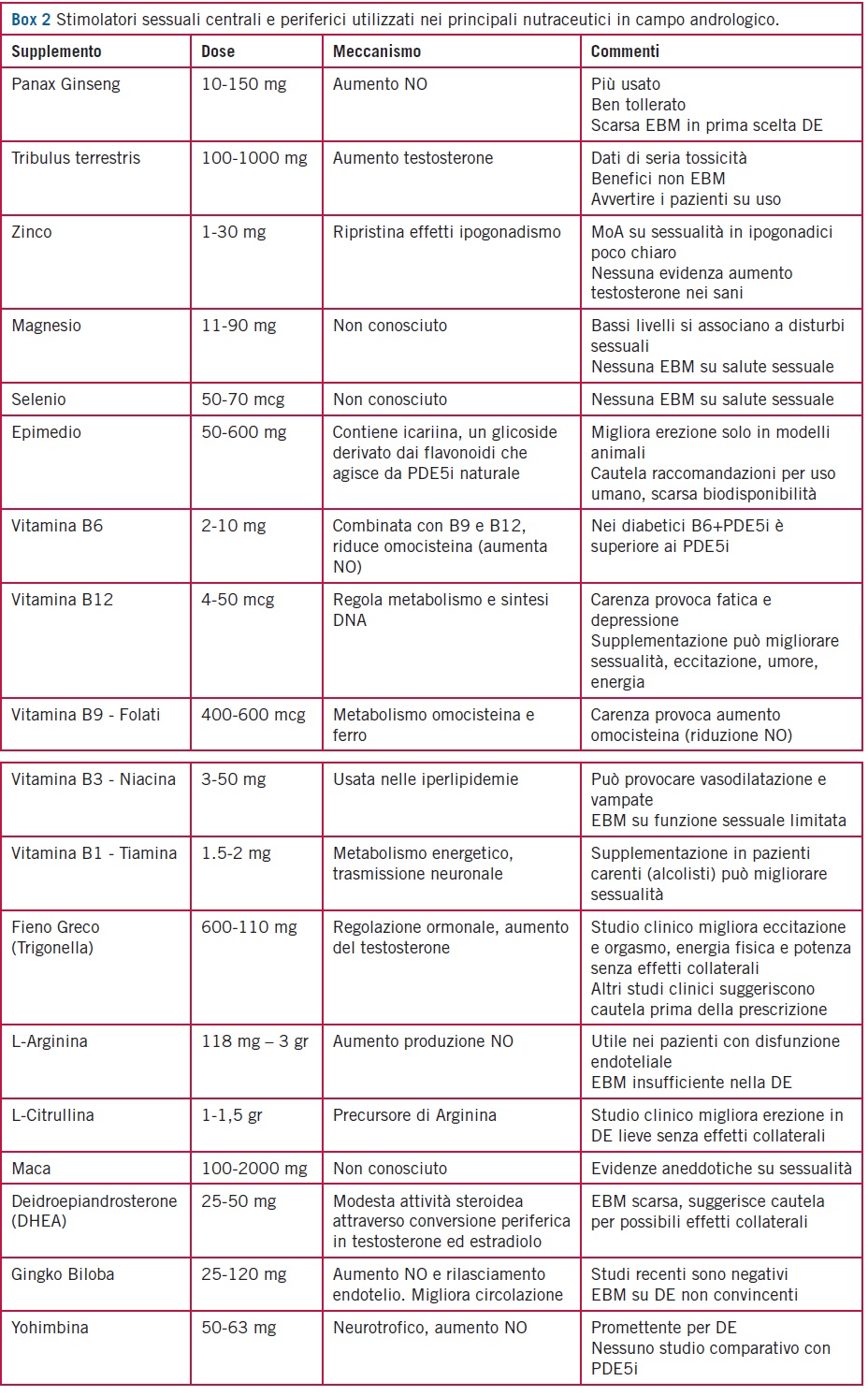
Per questo motivo, i nutraceutici attualmente disponibili dichiarano spesso di contenere sostanze attive sulla stimolazione della produzione di testosterone endogeno (Tribulus, Fieno Greco) sia per la funzione sessuale maschile che femminile.
In Box 2 sono elencati i principali composti utilizzati da soli o in combinazione, presenti nel mercato internazionale (Internet). Alcuni prodotti (yohimbina ed epimedium), sono nella “black list” del Ministero della Salute e non possono pertanto essere prodotti in Italia, mentre altri non presentano evidenza clinica di un chiaro meccanismo di azione nell’uomo (vi sono soltanto studi pre-clinici) e possono risultare pericolosi (Maca e Ginkgo biloba) in alcuni contesti psichiatrici. Esiste un solo studio di metanalisi sulla efficacia del Deidroepiandrosterone (DHEA) in soggetti anziani, che ha riportato un modesto effetto benefico sulla composizione corporea ma nessun effetto sulla sessualita [28].
In conclusione possiamo affermare che i nutraceutici rappresentano una alternativa utile all’utilizzo dei farmaci di prima linea (PDE5i) per il trattamento di alcuni disturbi sessuali ed in ristrette fasce di eta (ad esempio giovani ed anziani) laddove la medicalizzazione del disturbo sessuale puo rappresentare un problema aggiuntivo per il paziente. Tuttavia, in presenza di deficit erettivi di natura organica o di comorbilita importanti (ad esempio disturbi psichiatrici maggiori o assunzione di poli-farmacoterapie), si possono verificare importanti eventi avversi e pertanto si raccomanda un uso con molta cautela, sotto stretto controllo dello specialista. Infine, e importante raccomandare al paziente di non acquisire autonomamente formulazioni attraverso siti e-Commerce non certificati, per l’alta percentuale di contraffazione esistente in tali preparazioni.
Nutraceutica e prostata
I fattori nutrizionali e supplementi dietetici giocano un ruolo fondamentale nella regolazione delle patologie prostatiche in associazione con fattori genetici, ambientali, occupazionali e comportamentali. In particolare, frutta e verdura sono riconosciuti come agenti chemo-preventivi in accordo con il National Cancer Institute. Tra i vari meccanismi, ormonali e non, che possono essere coinvolti nella patogenesi e progressione dell’ipertrofia prostatica benigna (IPB), il ruolo dell’infiammazione cronica intra-prostatica e diventato sempre piu discusso.
Sino ad ora sono stati proposti diversi fattori promuoventi la flogosi cronica, comprese infezioni batteriche (Escherichia Coli, Neisseria gonorrea, Treponema pallidum, Chlamydia trachomatis), virali (HPV, Herpes simplex e CMV) o protozoarie (Trichomonas vaginalis), fattori dietetici e fattori ormonali [29]. In uno studio pioneristico, Nickel e colleghi hanno valutato il rapporto tra flogosi cronica, volume prostatico ed gravita dei Lower Urinary Tract Symptoms (LUTS) [30]. Hanno valutato 8224 uomini di eta compresa tra 50-75 anni con IPB, sottoposti a biopsia prostatica e inclusi nello studio REDUCE (REduction by DUtasteride of prostate Cancer Events). Il 77,6% dei pazienti presentava flogosi cronica e un volume prostatico piu elevato rispetto a quelli senza infiammazione (46,5 vs 43,4 mL; p<0,001), mostrando quindi un’associazione positiva tra l’infiammazione ed il volume prostatico. Sulla base di tali premesse, l’inibizione dell’infiammazione attraverso prodotti naturali puo avere un ruolo nel trattamento delle patologie prostatiche.
Carotenoidi
I carotenoidi (licopene, b-carotene) sono principalmente presenti negli ortaggi e in frutta dal colore giallo/arancione (pomodori e anguria), e sono ritenuti in grado di ritardare lo sviluppo di cellule cancerogene ed inibire la promozione tumorale [31]. Evidenze epidemiologiche associano infatti il consumo di licopene con la riduzione del rischio di insorgenza di tumore prostatico. In aggiunta, altri studi hanno evidenziato come una dieta ricca di licopene, per almeno 6 mesi, possa ridurre i livelli di PSA, migliorare i sintomi e ritardare la progressione dell’IPB [32].
Thè verde
Studi recenti indicano che esso possa avere un ruolo nella prevenzione del tumore prostatico avanzato, ma non nel tumore prostatico localizzato [33]. L’effetto chemopreventivo sembra essere mediato dai polifenoli (epigallocatechin-3-gallate) presenti nella teina ed in grado di determinare induzione di apoptosi, inibizione della crescita cellulare e arresto della progressione del ciclo cellulare [34]. Gli studi sulla prevenzione dell’IPB sono invece limitati.
Fitoestrogeni
I fitoestrogeni sono prodotti naturali classificati come flavoni e isoflavoni e sono altamente presenti nei prodotti di soia, nei cereali, nei legumi ed in vari semi e ortaggi [35]. Concentrazioni fisiologiche degli isoflavoni sono in grado di sotto-regolare i recettori degli androgeni delle cellule tumorali prostatiche. Essi inibiscono anche diversi enzimi come la 5á-reduttasi o l’aromatasi [33; 36].
Selenio
Il selenio e un nutriente essenziale contenuto in cereali, noci, legumi, carne, pollo, uova e tonno. Molti studi supportano il ruolo anti-carcinogenico del selenio attraverso l’induzione dell’apoptosi e dei pathway antiossidanti e attraverso l’inibizione della proliferazione cellulare e dell’angiogenesi [37]. Nonostante questo, lo studio SELECT (Selenium and Vitamin E Cancer Prevention Trial) ha dimostrato che selenio, vitamina E o selenio + vitamina E (alle dosi e formulazioni testate) non prevengono il tumore prostatico nella popolazione generale sana [38].
Vitamina E
La Vit. E e considerata uno dei tanti composti ad attivita anti-ossidante. Si trova naturalmente in alcuni cibi ed e disponibile come supplemento dietetico [39]. I dati a disposizione suggeriscono che l’introito di Vit. E puo ridurre il rischio di sviluppo di tumore prostatico, specialmente nei fumatori, ma attenzione a non introdurre piu di 400 UI, perche puo aumentare la mortalita per altre cause.
Serenoa repens
La serenoa repens e stata generalmente utilizzata per il trattamento dei sintomi in pazienti affetti da IPB. Diversi studi clinici hanno confrontato gli effetti della tamsulosina versus serenoa repens, dimostrando un’efficacia simile nel ridurre i sintomi. Recenti studi hanno proposto una tripla combinazione di serenoa repens e altri oligoelementi essenziali come selenio e il carotenoide licopene nel tentativo di aumentare la sua attivita terapeutica nelle malattie prostatiche [40]. In uno studio multicentrico, randomizzato, in doppio cieco, e stata valutata per la prima volta l’efficacia e la tollerabilita della terapia di combinazione serenoa repens, selenio e licopene+ tamsulosina 0,4 mg contro le monoterapie individuali nei pazienti IPB dopo 1 anno di follow-up [41]. A questo proposito, l’effetto anti-infiammatorio sul tessuto prostatico ha riportato una significativa riduzione dei livelli di interleuchina 1 e TNF-á dopo 3 mesi di trattamento con serenoa repens rispetto al placebo [42, 38]. Piu recentemente, Latil e colleghi hanno dimostrato che la serenoa repens inibisce l’espressione di due mediatori infiammatori, MCP-1/CCL2 e VCAM-1 fondamentali nella patogenesi dell’IPB [43].
I principali nutraceutici utilizzati nel campo delle patologie prostatiche sono elencati nel Box 1.
Bibliografia
[1] Tremellen K. Oxidative stress and male infertility – a clinical perspective. Hum Reprod Update. 2008; 14: 243-58.
[2] Bykova M, Athayde K, Sharma R et al. Defining the reference value of seminal reactive oxygen species in a population of infertile men and
normal healthy volunteers. Fertil Steril. 2007; 88: 305.
[3] Irvine DS. Glutathione as a treatment for male infertility. Rev Reprod. 1996; 1: 6-12.
[4] Lenzi A, Picardo M, Gandini L et al. Glutathione treatment of dyspermia: effect on the lipoperoxidation process. Hum Reprod. 1994; 9: 2044-50.
[5] Walczak-Jedrzejowska R, Wolski JK, Slowikowska-Hilczer J. The role of oxidative stress and antioxidants in male fertility. Cent European J Urol.
2013; 66: 60-7.
[6] Ciftci H, Verit A, Savas M et al. Effects of N-acetylcysteine on semen parameters and oxidative/antioxidant status. Urology. 2009; 74: 73-6.
[7] Jacob RA, Pianalto FS, Agee AE. Cellular ascorbate depletion in healthy men. J Nutr. 1992; 122: 1111-8.
[8] Mishra M, Acharya UR. Protective action of vitamins on the spermatogenesis in lead-treated Swiss mice. J Trace Elem Med Biol. 2004; 18: 173-8.
[9] Song GJ, Norkus EP, Lewis V. Relationship between seminal ascorbic acid and sperm DNA integrity in infertile men. Int J Androl. 2006; 29: 569-75.
[10] Wayner DDM, Burton GW, Ingold KU. The antioxidant efficiency of vitamin C is concentration-dependent. Biochim Biophys Acta. 1986; 884:
119-23.
[11] Therond P, Auger J, Legrand A et al. α-tocopherol in human spermatozoa and seminal plasma: relationships with motility, antioxidant enzymes
and leukocytes. Mol Hum Reprod. 1996; 2: 739-44.
[12] Lenzi A, Lombardo F, Gandini L et al. Metabolism and action of L-carnitine: its possible role in sperm tail function. Arch Ital Urol Nefrol Androl.
1992; 64: 187-96.
[13] Vicari E, Rubino C, De Palma A et al. Antioxidant therapeutic efficiency after the use of carnitine in infertile patients with bacterial or non
bacterial prostato-vesiculo-epididymitis. Arch Ital Urol Androl. 2001; 73: 15-25.
[14] Moncada, Vicari E, Cimino C et al. Effect of acetylcarnitine treatment in oligoasthenospermic patients. Acta Europaea Fertilitatis. 1992; 23: 221-4.
[15] Costa M, Canale D, Filicori M et al. L-carnitine in idiopathic asthenozoospermia: a multi center study. Andrologia. 1994; 26: 155-9.
[16] Vitali G, Parente R, Melotti C. Carnitine supplementation in human idiopathic asthenospermia: clinical results. Drugs Exp Clin Res. 1995;
21: 157-9.
[17] Banihani S, Agarwal A, Sharma R et al. Cryoprotective effect of l-carnitine on motility, vitality and DNA oxidation of human spermatozoa.
Andrologia. 2014; 46: 637-41.
[18] Balercia G, Buldreghini E, Vignini A et al. Coenzyme Q10 treatment in infertile men with idiopathic asthenozoospermia: a placebo-controlled,
double-blind randomized trial. Fertil Steril. 2009; 91: 1785-92.
[19] Safarinejad MR, Safarinejad S. Efficacy of selenium and/ or N-acetyl-cysteine for improving semen parameters in infertile men: a double-blind,
placebo controlled, randomized study. J Urol. 2009; 181: 741-51.
[20] Gvozdjakova A, Kucharska J, Dubravicky J et al. Coenzyme Q10, á-tocopherol, and oxidative stress could be important metabolic biomarkers
of male infertility. Dis Markers. 2015; 827941: 6.
[21] Condorelli RA, La Vignera S, Di Bari F et al. Effects of myoinositol on sperm mitochondrial function in-vitro. Eur Rev Med Pharmacol Sci.
2011; 15: 129-34.
[22] Gupta NP, Kumar R. Lycopene therapy in idiopathic male infertility – a preliminary report. Int Urol Nephrol. 2002; 34: 369-72.
[23] Showell MG, Brown J, Yazdani A et al. Antioxidants for male subfertility. Cochrane Database Syst Rev. 2011; CD007411.
[24] Pratap SA. & Rajender S. Potent natural aphrodisiacs for the management of erectile dysfunction and male sexual debilities. Front Biosci.
2012; 4: 167-180.
[25] Campbell N1, Clark JP, Stecher VJ et al. Adulteration of purported herbal and natural sexual performance enhancement dietary supplements
with synthetic phosphodiesterase type 5 inhibitors. J Sex Med. 2013; 10: 1842-9.
[26] European monitoring centre for drugs and drug addictions. Annual Report on the State of the Drugs Problem in Europe. Lisbon, Portugal. 2012.
[27] Aversa A, Francomano D, Lenzi A. Does testosterone supplementation increase PDE5-inhibitor responses in difficult-to-treat erectile dysfunction
patients? Expert Opin Pharmacother 2015; 16: 625-6.
[28] Corona G, Rastrelli G, Giagulli VA et al.Dehydroepiandrosterone supplementation in elderly men: a meta-analysis study of placebo-controlled
trials. J Clin Endocrinol Metab. 2013; 98: 3615-26.
[29] De Marzo AM, Platz EA, Sutcliffe S et al. Inflammation in prostate carcinogenesis. Nat Rev Cancer 2007; 7: 256-69.
[30] Nickel JC, Roehrborn CG, O’Leary MP, et al. The relationship between prostate inflammation and lower urinary tract symptoms: examination of
baseline data from the REDUCE trial. Eur Urol. 2008; 54: 1379-84.
[31] Steinmetz KA, Potter JD. Vegetables, fruit, and cancer. II. Mechanisms. Cancer Causes Control. 1991; 2: 427-42.
[32] Schwarz S, Obermuller-Jevic UC, Hellmis et al. Lycopene inhibits disease progression in patients with benign prostate hyperplasia. J Nutr.
2008; 138: 49-53.
[33] McConnell JD, Bruskewitz R, Walsh P et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment
among men with benign prostatic hyperplasia. Finasteride Long-Term Efficacy and Safety Study Group. N Engl J Med. 1998; 338: 557-63.
[34] Dahle SE, Chokkalingam AP, Gao YT et al. Body size and serum levels of insulin and leptin in relation to the risk of benign prostatic hyperplasia.
J Urol. 2002; 168: 599-604.
[35] Eikelis N, Schlaich M, Aggarwal A et al. Interactions between leptin and the human sympathetic nervous system. Hypertension. 2003; 41: 1072-9.
[36] Landsberg L. Feast or famine: the sympathetic nervous system response to nutrient intake. Cell Mol Neurobiol. 2006; 26: 497-508.
[37] Siddiqui IA, Adhami VM, Saleem M et al. Beneficial effects of tea and its polyphenols against prostate cancer. Mol Nutr Food Res. 2006; 50: 130-43.
[38] Klein EA, Thompson IM Jr, Tangen CM, et al. Vitamin E and the risk of prostate cancer: the selenium and vitamin E cancer prevention trial
(SELECT). JAMA. 2011; 306: 1549-56.
[39] Montironi R, Mazzucchelli R, Marshall JR et al. Prostate cancer prevention: review of target populations, pathological biomarkers, and chemopreventive
agents. J Clin Pathol. 1999; 52: 793-803.
[40] Minutoli L, Bitto A, Squadrito F et al. Serenoa Repens, lycopene and selenium: a triple therapeutic approach to manage benign prostatic
hyperplasia. Curr Med Chem. 2013; 20: 1306-12.
[41] Morgia G, Russo GI, Voce S et al. Serenoa repens, lycopene and selenium versus tamsulosin for the treatment of LUTS/BPH. An Italian multicenter
double-blinded randomized study between single or combination therapy (PROCOMB trial). Prostate. 2014; 74: 1471-80.
[42] Vela Navarrete R, Garcia Cardoso JV, Barat A et al. BPH and inflammation: pharmacological effects of Permixon on histological and molecular
inflammatory markers. Results of a double blind pilot clinical assay. Eur Urol. 2003; 44: 549-555.
[43] Latil A, Libon C, Templier M, et al. Hexanic lipidosterolic extract of Serenoa repens inhibits the expression of two key inflammatory mediators,
MCP-1/CCL2 and VCAM-1, in vitro. BJU Int. 2012; 110: E301-7.





