Probiotico è un termine coniato negli anni ’60, attraverso una strana mistura di latino (pro: a favore) e greco (biotico: della vita) per definire dapprima sostanze e poi microrganismi con azione di supporto alla crescita delle comunità microbiche ospitate in vari organi degli animali, primo fra tutti l’intestino umano.1
Probiotico si caratterizza quindi come parola antitetica ad antibiotico, non solo etimologicamente ma anche come concetto: il supporto allo stato di salute si ottiene aumentando la presenza microbica e non diminuendola.
Un’analisi delle definizioni riportate in Tabella 1 evidenzia come il termine abbia assunto significati diversi, a partire dalla definizione originaria, che oggi si identificherebbe più con le sostanze ad azione prebiotica che con i microrganismi benefici, cambiando poi radicalmente e ponendo l’accento sui “mi- crorganismi” (sempre vivi e vitali) e introducendo poi la necessità di una “adeguata quantità”.
Oggi si può considerare la definizione abbastanza stabilizzata1 con alcuni punti fermi:
- i probiotici sono microrganismi vivi e vitali al momento dell’uso;
- la loro efficacia è legata al consumo di una “adeguata quantità”;
- il loro uso deve portare un beneficio per la salute o il benessere
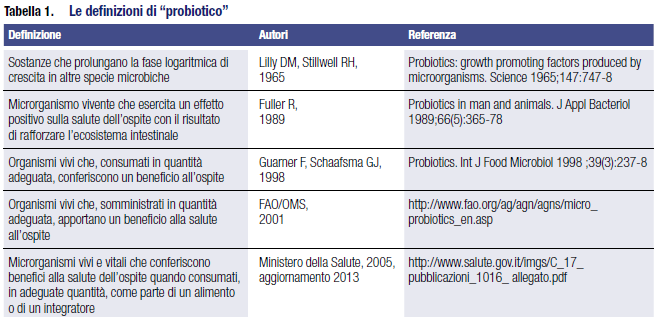
In tutte le definizioni che sono comparse nel corso degli anni si pone l’accento sulla necessità che i microrganismi siano vivi e vitali al momento del consumo.
Al termine diquesta sezione introduttiva è bene soffermarsi sulla definizione data da un gruppo di lavoro coordinato da FAO e WHO: “organismi vivi che, somministrati in quantità adeguata, apportano un beneficio alla salute all’ospite”.2 Questa definizione ha assunto valore di riferimento normativo in diversi Paesi, inclusi l’Italia,3 il Belgio,4 il Canada (Health Canada, 2009), gli USA,5 l’India.6
Poiché l’uso ai fini regolatori della definizione FAO/WHO ha avuto e sta avendo pesanti ricadute per la situazione normativa dei probiotici all’interno dell’Unione Europea, sembra opportuno fornire qualche dettaglio in più, anche alla luce della personale esperienza vissuta come partecipante al lavoro di questa Expert Consultation.
I documenti prodotti dal lavoro di questo gruppo di esperti sono due, pubblicati rispettivamente nel 2001 e nel 2002, anche se a volte vengono erroneamente citati con la data del 2006, anno in cui sono stati ristampati in un documento unico.
Nel primo, oltre alla definizione sopra riportata nonché in Tabella 1, si precisa come l’oggetto della Expert Consultation sia una:“evaluation of the scientific evidence available onthe properties, functionality, benefits, safety, and nutritional features of probiotic foods.”
Da sottolineare la ripetuta insistenza sul “food” come oggetto del lavoro degli esperti; infatti nella sezione del documento del 2001 si precisa come “the scope of themeeting would include probiotics and prebiotics in food, and exclude reference to the term biotherapeutic agents, and beneficial microorganisms not used in food”.
I farmaci e l’uso non alimentare dimicrorganismi benefici sono quindi esplicitamente esclusi, fatto non sempre pienamente compreso soprattutto dal mondo clinico, che fa spesso riferimento alle procedure illustrate in questo documento anche in caso di uso dei probiotici in soggetti patologici.7,8
È inoltre da sottolineare come le definizioni nella sezione 3 del documento siano in effetti due: “The Consultation has redefined probiotics for the purpose of this meeting as ‘Live microorganisms which when administered in adequate amounts confer a health benefit on the host’, but restricted its scope to discussion of ‘Live microorganisms which when consumed in adequate amounts as part of food confer a health benefit on the host”.
Questo significa come la definizione si possa anche applicare a prodotti non alimentari (ad esempio prodotti topici per la pelle, per uso vaginale ecc.) ma che la documentazione esaminata dagli esperti nel corso dei due anni di lavoro si sarebbe limitata all’uso alimentare dei probiotici stessi.
In entrambi i documenti si nota la rilevanza della corretta identificazione tassonomica dei microrganismi utilizzati, per tutelare la sicurezza del consumatore ma anche per assicurare l’efficacia del prodotto che, come visto in precedenza, può essere legata a specificità proprie del singolo individuo microbico, il cosiddetto “ceppo”.
Si arriva anche, in questi documenti, a stilare un elenco delle tecniche analitiche più adatte a identificare, a livello di specie ma anche di ceppo, i microrganismi probiotici.
Nel documento del 2002 si ammette una sola eccezione all’identificazione spinta fino al livello del cep- po, precisamente nel caso dei batteri utilizzati per la produzione di yogurt e della loro azione idrolitica sul lattosio; in questo caso l’identificazione si può fermare a livello della specie, in quanto la presenza dell’enzima beta-galattosidasi (lattasi) è comune a tutti i ceppi delle due specie usate (Lactobacillus del- brueckii subsp. bulgaricus e Streptococcus thermophilus) e in quantità sufficiente ad assicurare una idrolisi del lattosio a livelli tali da poter essere tollerato anche da soggetti lattosio-intolleranti.
Curiosamente, questa eccezione si accompagna anche ad un’altra situazione anomala: infatti in questo caso l’azione probiotica richiede che i batteri siano vivi al momento dell’ingestione ma che vengano devitalizzati e lisati durante il transito intestinale, perconsentire la liberazione dell’enzima nel lumeintestinale.9
La definizione del termine probiotico, avvenuta come abbiamo visto agli inizi degli anni 2000, ha coinciso con una vera e propria esplosione dell’interesse dei ricercatori: la ricerca sui data base della letteratura clinica (www.gopubmed.org) segnala come nel 2001, anno del primo documento FAO/WHO, gli articoli pubblicati e contenenti le parole chiave “probiotics” e “humans” non arrivassero a 200; 5 anni dopo erano raddoppiati e nel 2013 e 2014 hanno superato gli 800 articoli/anno.
Da tenere presente come l’Italia, da sempre, occupi il secondo posto come articoli pubblicati (oltre 600) contro i circa 1200 degli USA (primo posto) e i 400 della Gran Bretagna (terzo posto).
Questo primato di ricerca ha anche prodotto una attenzione normativa da parte del Ministero della Salute, con l’emanazione diuna serie di linee guida, che verranno esaminate più avanti in questo capitolo.
❚ La situazione in Europa
A questo punto si deve prendere in considerazione cosa sia, in termini regolatori, un “alimento” nel contesto normativo dell’Unione Europea (si ricorda che tutta la legislazione europea è scaricabile dal sito: http://eur-lex.europa.eu/); per far ciò dobbiamo far riferimento all’art. 2 Reg. CE 178/2002 che stabilisce: “…si intende per «alimento» (o «prodotto alimentare», o «derrata alimentare») qualsiasi so- stanza o prodotto trasformato, parzialmente trasformato o non trasformato, destinato ad essere ingerito, o di cui si prevede ragionevolmente che possa essere ingerito da esseri umani. Sono comprese le bevande, le gomme da masticare e qualsiasi sostanza, compresa l’acqua, intenzionalmente incorporata negli alimenti nel corso della loro produzione, preparazione o trattamento”.
È inoltre necessario introdurre la definizione legale di “farmaco” così come definita dalla Direttiva 2004/27/CE: “Ogni sostanza o associazione di sostanze presentata come avente proprietà curative o profi- lattiche delle malattie umane. Ogni sostanza o associazione di sostanze che possa essere utilizzata nell’uomo o somministrata all’uomo allo scopo di stabilire una diagnosi medica odi ripristinare, correggere omodificare funzioni fisiologiche, esercitando una azione farmacologica, immunologica o metabolica.”
Questa breve rassegna normativa termina con un ultimo Regolamento, il 1169/2011, concernente l’etichettatura e la presentazione al consumatore degli alimenti. In particolare, all’art. 7 “Pratiche leali di Informazione” il Regolamento stabilisce che le informazioni sugli alimenti non debbano indurre in errore il consumatore, in particolare: “…le informazioni sugli alimenti non attribuiscono a tali prodotti la proprietà di prevenire, trattare o guarire una malattia umana, né fanno riferimento a tali proprietà”.
È questo comma dell’articolo 7 a bloccare per gli alimenti ognipossibilità di riferimento a effetti positivi sulla salute; solo al farmaco è data infatti la possibilità di “presentarsi come avente proprietà curative o profilattiche delle malattie umane”. Diventa quindi evidente la contraddizione fra la definizione stessa di probiotico, che lega la parola stessa a un effetto benefico sulla salute, e la normativa dell’Unione Europea, che nega agli alimenti la possibilità di vantare effetti sulla salute.
La Codex Alimentarius Commission (organo congiunto di FAO e WHO) già nel 1997 (www.codexa- limentarius.org) aveva stabilito come gli alimenti potessero, a determinate condizioni, utilizzare dei claims nutrizionali e dei claims sulla salute. In particolare, per questo secondo tipo di claims, Codex Alimentarius fornisce una definizione e tre tipologie diverse.
La definizione è: “Health claim means anyrepresentation that states, suggests, or implies that a relationship exists between a food or a constituent of that food and health”, mentre le tre tipologie sono:
- Nutrient function claims – A nutrition claim that describes the physiological role of the nutrient in growth, development and normal functions of the
- Other function claims – These claims concern specific beneficial effects of the consumption of foods or their constituents, in the context of the total diet on normal functions or biological activities of the Such claims relate to a positive contribution to health or to the improvement of a function or to modifying or preserving health.
- Reduction of disease risk claims – Claims relating the consumption of a food or food constituent, in the context of the total diet, to the reduced risk of developing adisease orhealth-related Risk reduction means significantly altering a major risk factor(s) for a disease or health-related condition.
Queste tipologie di claims sono state, nel 2006, riprese nel Reg. 1924 della Commissione Europa, inti- tolato appunto “Health Claims Made on Food”.
La filosofia di questo Regolamento è quella di consentire delle “eccezioni motivate” al divieto, che permane come regola generale, posto agli alimenti di poter fare riferimenti a effetti salutistici.
Queste eccezioni devono seguire un iter autorizzativo (dettagliato nel Reg. 358/2008) che prevede l’esame del dossier contenente le evidenze scientifiche e cliniche dell’efficacia dell’alimento/ingrediente da parte di un panel di EFSA, l’Autorità Europea per la Sicurezza Alimentare.
Per quanto riguarda la possibilità di comunicare al consumatore europeo le proprietà benefiche dei probiotici, il Reg. 1924/2006 aveva suscitato molte speranze, visto la grande attività di ricerca svolta in Europa, ricerca funzionale allo sviluppo e messa in commercio di molti prodotti, alimenti e integratori, a base di probiotici.
Sorprendentemente, di oltre 200 domande fino ad oggi presentate per l’ottenimento di claims per pro- dotti contenenti probiotici, nessuna è riuscita a superare il vaglio di EFSA e di queste ben 171 con la seguente motivazione: “food is not sufficiently characterised for a scientific assessment of this claimed effect and the claim could not therefore be substantiated” (ec.europa.eu/nuhclaims).
È quindi una non sufficiente o non corretta caratterizzazione dei microrganismi usati10 a motivare circa il 75% delle valutazioni negative; cosa sorprendente in quanto EFSA nel 2009 richiede una identificazione che ricalca pedissequamente le indicazioni fornite dall’Expert Consultation nel 2001 ed evidentemente ignorate dalle aziende richiedenti l’approvazione di un claim.
Per le altre il motivo della mancata autorizzazione è indicato in questo modo: “on the basis of the scientific evidence assessed, this claimed effect for this food has not been substantiated” ma questo generico giudizio si può suddividere in almeno tre categorie:
- l’effetto sulla salute è accettabile ai sensi della Regolamentazione ma le evidenze portate a supporto non sono sufficienti, molte volte per una carente impostazione dei clinical trials;
- l’effetto sulla salute non è accettabile; ad esempio il riequilibrio del microbiota intestinale, la cui composizione “ideale” da riequilibrare non è ritenuta nota dal Panel EFSA;
- le evidenze presentate sono ottenute utilizzando soggetti in situazioni patologiche; poiché però l’oggetto dell’autorizzazione è un alimento e non un farmaco, queste evidenze non sono accettate d EFSA come dimostrazione di efficacia in persone sane, come quelle a cui si dovrebbe rivolgere un alimento, sia pure con health
Inoltre il Panel NDA, nel 200910 esprime il parere che “incrementare il numero di un qualsiasi gruppo di batteri” come “aumentare i livelli di microflora benefica” non comportino effetti benefici sulla salu- te; questo tipo di azione è alla base di molti studi sull’efficacia dei probiotici, studi che hanno portato al massimo il livello di consenso scientifico quale espresso nelle meta-analisi, nelle Cochrane reviews e in alcune linee guida di Società Scientifiche Internazionali, quali la World Allergy Organization11,12 e l’ESPGHAN.13
La principale, anche se non unica, motivazione per questa sostanziale diversità di giudizio fra il mondo accademico e l’Autorità europea si trova nel tipo di soggetti reclutati per gli studi d’efficacia; se patologici (ad esempio trattati con antibiotici per una qualsiasi patologia, anche non intestinale) il Panel EFSA considera i risultati non accettabili, in quanto non fanno riferimento a una popolazione sana, a cui gli alimenti, sia pure con health claim, si devono indirizzare.
Vedremo più avanti che questa rigida interpretazione dello status di alimento non sia condivisa da altri enti regolatori.
Un altro motivo prevalente nella giustificazione dei giudizi negativi è la non rispondenza del disegno del trial clinico agli standard necessari per produrre non un’evidenza scientifica, ma bensì una certezza regolatoria.
Per questo aspetto l’impostazione e il trattamento statistico dei dati assumono una rilevanza maggiore per gli scopi regolatori che per quelli accademici, dove a volte basta rilevare una “tendenza” positiva per concludere positivamente sull’efficacia di un trattamento.
L’unica Opinion di EFSA positiva per le colture batteriche benefiche è quella relativa all’azione idrolitica sul lattosio delle colture batteriche usate per produrre lo yogurt, cioè proprio quel caso eccezionale illustrato nel secondo documento FAO/WHO in cui l’efficacia è dovuta alla morte dei batteri durante il transito intestinale.
Questa Opinion è stata poi recepita e oggi il claim “Live cultures in yoghurt or fermented milk improve lactose digestion of the product in individuals who have difficulty digesting lactose” è recepito e utilizzabile.
In conclusione non si può non notare come risulti paradossale che, a fronte di una imponente quantità di ricerca e di sviluppo prodotti svolta prevalentemente in Europa, l’unico claim ammesso sia quello relativo a una proprietà benefica nota fin dagli anni ’50 del secolo scorso.
❚ Le linee guida EFSA
I problemi affrontati dal settore dei probiotici nell’ottenere health claims sono stati condivisi dalla maggior parte delle tipologie di prodotti con effetti sulla salute che hanno presentato domanda; in buona sostanza sono stati autorizzati claims relativi a vitamine, minerali e comunque ad alimenti e ingredienti le cui azioni positive sono storicamente note.
La rivoluzione copernicana auspicabilmente introducibile dal Reg. 1924 è risultata essere, almeno fino ad ora, una “restaurazione conservatrice” che ha prevalentemente premiato solo il già noto e consolidato.
Questa situazione ha evidenziato come fosse necessario avere delle indicazioni più precise, delle vere e proprie linee guida per supportare le aziende che richiedono l’approvazione dei claims.
Al momento sul sito EFSA sono disponibili nuove linee guida.
D’interesse per questo capitolo le linee guida relative all’intestino e alle funzioni immunitarie. Quelle attualmente in vigore sono del 2011 ma è in corso di ultimazione la stesura della revisione 2015, la cui bozza è già disponibile (Draft Scientific Opinion “Guidance on the scientific requirements for health claims related to the gastro-intestinal tract, the immune system, and defence against pathogenic micro- organisms”).
Lo stato della ricerca alla luce delle nuove Linee Guida EFSA
Viste le novità, le precisazioni e le aperture del nuovo (ancora da pubblicare al momento della stesura di questo capitolo) documento di riferimento dell’EFSA, sembra interessante passare in rassegna lo “stato dell’arte” della ricerca per quanto riguarda alcuni dei claims ammissibili per i probiotici secondo EFSA, con particolare attenzione alle “popolazioni sane” che possono essere arruolate per dimostrare l’efficacia di un probiotico.
Claims sul discomfort gastro-intestinale
Questo tipo di indicazioni sulla salute è d’interesse in quanto vi sono, secondo EFSA, due popolazioni target che possono essere utilizzate:
- adulti: le persone affette da Sindrome da Colon Irritabile (useremo qui l’acronimo IBS dall’inglese Irritable Bowel Syndrome)
- età pediatrica: le linee guida propongono come popolazione target i neonati con coliche
Un esame della letteratura scientifica presente, all’agosto 2015, su PubMed (http://www.ncbi.nlm.nih. gov/) sotto le parole chiave IBS & Probiotics dimostra una notevole attività di ricerca, con oltre 300 articoli recensiti; di questi il filtro “clinical trial” ne seleziona 72; i dati essenziali relativi a questi trials sono riportati in Tabella 2.
A questa prima analisi quantitativa facciamo ora seguire un esame qualitativo, utilizzando due recenti meta-analisi.
Per quanto riguarda l’uso dei probiotici nell’IBS in pazienti adulti, Didari e coll.14 analizzano stati- sticamente i risultati ottenuti su un totale di 1793 pazienti.

Gli effetti valutati erano:
- la riduzione dei dolori addominali
- l’indice globale dei sintomi
- la flatulenza, il meteorismo e la distensione
Gli autori concludono che i probiotici, quando comparati al placebo, possono ridurre il dolore addominale e migliorare il profilo globale dei sintomi.
Poiché questi effetti sono stati osservati con prodotti probiotici diversi fra loro sia per la composizione in ceppi che per la dose di cellule vitali, si può pensare come questi effetti siano da attribuire a un’azione generale di riequilibrio del microbiota intestinale.
Proprio l’eterogeneità delle preparazioni probiotiche usate, se da una parte è un’indicazione diun’effica- cia generalizzata, è però anche un punto di debolezza, in quanto per nessun prodotto si hanno evidenze ottenute con un numero di soggetti trattati elevato.
Per quanto riguarda l’IBS pediatrica la situazione è diversa per quanto riguarda i prodotti probiotici usati ma simile nelle conclusioni.
In una meta analisi pubblicata nel 201315 sono stati valutati 5 studi con la forma diarroica dell’IBS e 4 studi concernenti quella caratterizzata dalla stipsi, ma una preparazione è stata usata in 4 trials, andando quindi a costituire un blocco di dati statisticamente rilevante.
La riduzione dei doloriaddominalinelle forme diarroiche di IBSè unodeisintomiche più traggono giovamento dal trattamento con i probiotici in età pediatrica, mentre le forme caratterizzate dalla stipsi sembrano non beneficiare dell’uso di questi prodotti.
Dal punto di vita della ricerca gli Autori concludono che: “Non vi sono abbastanza dati per concludere che vi sia un particolare probiotico più efficace di altri”, ma anche “Lanostra systematic review hadimostrato come i probiotici siano più efficaci del placebo nel trattamento di pazienti con dolori addominali dovuti a malattie gastro-intestinali, in particolare per soggetti affetti da IBS”.
In un’altra recente review16 si arriva alle stesse conclusioni, rafforzando quindi, per quanto riguarda il meccanismo d’azione, un riequilibrio delle varie componenti del microbiota intestinale.
Per quanto riguarda le coliche gassose i trials clinici sono stati prevalentemente condotti con un ceppo appartenente alla specie Lactobacillus reuteri; questa circostanza ha reso possibile effettuare una meta
analisi17 sui risultati ceppo specifici, prendendo in considerazione sei studi per un totale di 213 soggetti trattati e di 210 soggetti trattati con placebo.
L’analisi statistica mette in luce l’efficacia diquesto ceppo nelle prime tre settimane ma una diminuzione in quarta settimana, osservazione questa rafforzata dai dati dell’unico lavoro che riporta un outcome negativo ma che ha utilizzato soggetti di età maggiore rispetto agli altri lavori.18 Gli autori concludono che: “Lactobacillus reuteri possibly increased the effectiveness of treatment for infantile colic and decreased crying time at two to three weeks without causing adverse events“.
Claims sulle difese immunitarie in situazioni patologiche
Tre le linee di ricerca che, secondo EFSA, possono servire a supportare la richiesta di un claim relativo alla difesa contro agenti patogeni. L’argomento è particolarmente delicato, vista la prossimità con situa- zioni patologiche che, per la legislazione, devono essere trattate solo con farmaci e per questo motivo si riporta qui il testo originale delle Linee Guida:
- Studi di intervento sull’uomo mostrano uneffetto sui risultati clinici relativi a infezioni (ad incidenza, gravità e/o la durata dei sintomi).
- Risposte più elevate alla vaccinazione (comemisurato daun aumentato numero di persone che raggiun- gono livelli protettivi di titoli anticorpali) sono opportune variabili di risultato per la fondatezza scientifica delle indicazioni relative alla difesa immunitaria contro i patogeni.
- Attività antibatterica (nell’uomo).
In letteratura la presenza di articoli relativi alle tre tipologie sopra riportate è numerosa; in Tabella 3 una sintesi dei clinical trials pubblicati negli ultimi tre anni, tenendo però conto che alcuni trials compaiono sia nella sezione “infezioni” che in quella “attività anti-batterica”.
Questa vasta ma eterogenea letteratura è stata oggetto di alcune metanalisi e di Cochrane Reviews.
In particolare ci affideremo qui a queste ultime per tratteggiare lo scenario della ricerca in questo particolare settore. La più recente riguarda le infezioni delle vie respiratorie superiori (URTI) e riguarda 12 RCT per un totale di 3720 partecipanti, sia adulti, ragazzi e anziani.19
L’analisi statistica ha evidenziato un effetto positivo rispetto al placebo nel ridurre del 47% il numero degli episodi di infezioni acute e la loro durata media (1,8 giorni in meno) come pure una riduzione nella prescrizione di antibiotici.
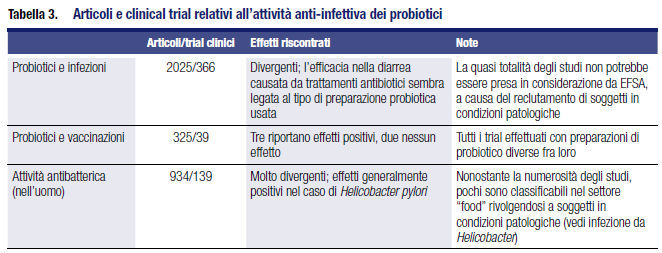
Goldenberg et al.20 hanno analizzato la capacità dei probiotici nel ridurre l’incidenza delle infezioni da Clostridium difficile (CDAD): l’analisi di questi autori ha preso in considerazione 23 trials con 4213 partecipanti e i risultati suggeriscono una robusta azione preventiva dei probiotici, che riducono il rischio infettivo del 64%.
La prossima Cochrane che passeremo in rassegna, benché concerna l’uso di probiotici in una popola- zione in condizioni patologiche, precisamente la prevenzione della diarrea acuta pediatrica a seguito di trattamenti antibiotici, risulta interessante perché gli autori21 concludono come vi sia un effetto ceppo-specifico dell’efficacia riscontrata in questa azione preventiva (Lactobacillus rhamnosus e Saccha- romyces boulardii).
Altre analisi Cochrane rafforzano l’efficacia “anti batterica” dei probiotici, ma analizzano dati ottenuti con soggetti in condizioni patologiche e quindi non di interesse per questo capitolo.
Claims relativi al benefico cambiamento nella risposta agli allergeni
Queste indicazioni possono essere dimostrate, secondo EFSA, attraverso studi umani che mostrano una diminuzione dell’incidenza, della gravità e/o della durata delle manifestazioni allergiche in soggetti a rischio di reazioni allergiche, ma privi di sintomi di riferimento.
L’argomento raccoglie più di 900 articoli in PubMed di cui 171 clinical trials, ma all’interno di questo filone di ricerca sono moltissimi i vari settori.
La meta-analisi di 5 studi (outcomes di 1477 soggetti) ha dimostrato una riduzione significativa nell’eczema infantile ma gli autori notano una forte eterogeneità fra i vari studi.
È sostanzialmente lo stesso quadro delle sezioni precedenti; l’indicazione di una azione benefica dei probiotici esiste ma la sua trasformazione in una chiara e netta indicazione d’uso deve ricevere un più forte supporto scientifico, meglio finalizzato alle richieste degli enti regolatori.
Stato normativa extra Unione Europea
Sembra interessante a questo punto esaminare quanto accade in altre parti del mondo; un recente documento del New Zealand Ministry for Primary Industries22 fornisce un elenco dei Paesi che hanno regolamentato l’uso di health claims: Australia/Nuova Zelanda, Canada, Cina, Unione Europea, Hong Kong; India, Indonesia, Giappone, Malesia, Filippine, Singapore, Svizzera, Taiwan, Tailandia, USA, Vietnam. In molti di questi Paesi si identificano due tipi di claims: quelli sulla “funzionalità” e quelli sulla “riduzione del rischio” di contrarre patologie, acute o croniche.
Contrariamente all’Unione Europea, però, dove esistono solo dei claims pre-approvati per i nutrienti (allegato 1 del Reg. 1924) ma non per gli health claims, la quasi totalità dei Paesi di cui sopra ha una lista di claims sulla salute pre-approvati.
Si tratta di indicazioni sulla salute ritenute corrette, sulla base delle esistenti evidenze scientifiche, il cui uso è autorizzato a condizione che si rispettino alcuni requisiti, in modo sostanzialmente identico ai claims nutrizionali dell’All. 1 del Reg 924/2006.
Ad esempio l’agenzia Health Canada pubblica, nel 2009, un documento guida per i probiotici che, mentre da un lato adotta un atteggiamento stringente (si veda elenco seguente) per quanto riguarda la definizione di probiotico, include anche indicazioni generiche come potenziali health claims che necessitano di approvazione:
“A probiotic health claim can consist of one of the following examples:
- the term ‘probiotics’ and similar terms or representations;
- with beneficial probiotic cultures;
- contains bacteria that are essential to a healthy system;
- Latin name of a microbial species modified to suggest a health benefit”.
Questa restrizione è però accompagnata da una notevole apertura sulla tipologia di claims pre-approvati “non collegabili a un ceppo specifico”.
Per Health Canada infatti, esistono due tipologie di claims:
- Disease Risk Reduction or Therapeutic Probiotic Claims (assimilabili ai claims ex art 14 della legislazione europea) e
- Probiotic Function Claims (assimilabili a quelli ex art 13 della legislazione EU)
- a loro volta suddivisi in:
- Strain-specific claims are claims about the health benefits or effects of specific strains of
- Non-strain-specific claims are statements A closed list of non-strain-specific probiotic claims that are acceptable without theneed for the manufacturer to conduct adetailed review of the scientific basis for the claim is provided in the Table of Acceptable Non-Strain Specific Claims for Probiotics.
La seconda tipologia (Tabella 4) è veramente innovativa e preconizzatrice di quanto 6 anni dopo verrà pubblicato da un gruppo di esperti.1
Le quattro diciture si possono usare se il prodotto contiene ceppi appartenenti alle 16 specie batteriche elencate, in base alla letteratura in una quantità non inferiore a 1 miliardo per porzione per ceppo.
Per inciso, questo approccio è molto simile a quello seguito dal Ministero della Salute italiano che, nella revisione del 2013 delle Linee Guida su Probiotici e Prebiotici, fissa la stessa dose per batteri “tradizionalmente usati” e determina una sola indicazione d’uso. “Favorisce l’equilibrio della flora intestinale”, cioè sostanzialmente identica a uno dei claim ammessi da Health Canada.
Anche in uno dei Paesi più vicini a noi come la Svizzera la situazione diverge da quella dell’Unione Europea: infatti, benché fra Unione Europea e Svizzera vi sia, nel settore alimentare, una forte somiglianza legislativa, nel caso dei claims registriamo delle differenze.
Nel 2013, cioè 3 anni dopo aver ritirato la domanda di claim a EFSA, Danone ottiene dalle competenti autorità svizzere il permesso di utilizzare il claim “Activia contributes to digestive comfort by reducing transit time and bloating.” Il claim è stato concesso sulla base degli stessi studi clinici che facevano parte del dossier presentato a EFSA.
L’anno dopo sarà il gruppo DuPont-Danisco a ottenere dalle autorità svizzere un claim per un Bifido- bacterium probiotico.
È motivo di riflessione questa differenza di valutazione di un Paese che pure si riferisce esplicitamente alla legislazione europea (http://www.blv.admin.ch/) per quanto riguarda gli health claims made onfood.

❚ Conclusioni
Appare evidente, da quanto sopra riportato, la profonda divisione fra le convinzioni del mondo accademico e della ricerca e gli esiti della valutazione ai fini regolatori.
La ricerca da circa 20 anniritiene quello deiprobiotici unsettore in cui investire risorse per l’avanzamento delle conoscenze relativamente al rapporto fra salute e batteri, identificando questi ultimi non più nei soli agenti patogeni ma bensì come potenziali mezzi per il mantenimento diun buon stato di salute; accanto a queste linee di ricerca sta pure crescendo un interesse per l’uso dei batteri come veri e propri farmaci.
Dall’altra parte le autorità regolatorie applicano un’elevata dose diprudenza nel valutare l’uso di indicazioni sulla salute da parte degli alimenti; prudenza giustificata dal fatto che, contrariamente al farmaco, l’alimento è di libero accesso al consumatore, senza nessun controllo medico.
Inoltre il settore degli alimenti basa la valutazione della sicurezza principalmente sulla “lunga storia d’uso sicuro” e le innovazioni hanno sempre avuto vita difficile.
Vi è la necessità di una nuova fase della ricerca applicata al settore degli alimenti che aspirino a utilizzare indicazioni sulla salute; ricerche che tengano ben presenti le linee guida degli enti regolatori e che ab- biano lo scopo di fornire dati utilizzabili non per l’avanzamento della conoscenza, ma per consolidare i risultati ottenuti con i lavori “pionieristici”.
Gli effetti sul mantenimento del benessere individuale a lungo termine e, più ancora, le possibili azioni di tipo quasi farmacologico in molteplici settori, promettono di aprire scenari di notevole impatto sulla salute, a costi tra l’altro notevolmente contenuti. In conclusione, ecco le principali evidenze su cui c’è maggiore consenso scientifico, alla luce attuale delle conoscenze:
- influenzare la composizione del microbiota, mediante la somministrazione di batteri probiotici, può contribuire in modo significativo alla salute e al benessere dell’ospite;
- lo studio dei possibili effetti favorevoli di miscele di ceppi deve essere specifico, e non limitarsi a “sommare” le evidenze relative agli effetti dei vari ceppi miscelati;
- dai dati sperimentali va estrapolata anche la quantità di batteri vivi da somministrare, ed eventual- mente gli effetti della matrice in cui essi vengono somministrati; tale somministrazione deve essere prolungata, in alcuni casi per tempi indefiniti;
- nei soggetti sani, alcuni probiotici contribuiscono in modo significativo alla regolarizzazione dell’alvo e alla riduzione del discomfort intestinale;
- alcuni probiotici possono antagonizzare i patogeni intestinali con un’azione di antagonismo diretto (vale a dire: produzione di citochine, defensine e così via), o per esclusione competitiva;
- alcuni probiotici contribuiscono alla prevenzione della diarrea infettiva nei bambini;
- alcuni probiotici sono associati a un globale miglioramento dei disordini funzionali intestinali (gon- fiore, fastidio addominale ) tipici della sindrome dell’intestino irritabile;
- alcuni probiotici, probabilmente grazie alla stimolazione di vie dell’immunità aspecifica, sembrano in grado di ridurre la durata e/o la gravità di patologie virali stagionali;
- segnalazioni preliminari, anche se non del tutto univoche, suggeriscono che specifici ceppi diprobio- tici possano ridurre l’incidenza, o alcuni aspetti dermatologici, delle patologie allergiche nel bambino;
- gli alimenti contenenti probiotici hanno dimostrato la loro sicurezza sia nella popolazione sana sia in soggetti affetti da alcune
❚ Bibliografia
- Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, et Expert consensus document. The International Scientific Association for Probiotics and Prebiotics con- sensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol 2014 Aug;11(8):506-14.
- Food and Agricultural Organization of the United Nations and World Health Organization (FAO/WHO). Health and nutritional properties of probiotics in food including powder milk with live lactic acid ftp://ftp.fao.org/docrep/ fao/009/a0512e/a0512e00.pdf
- Ministero della Salute, Linee Guida Probiotici e Prebiotici, http://www.salute.gov.it/imgs/C_17_pubblicazi- oni_1016_allegato.pdf
- Huys G, Botteldoorn N, Delvigne F, De Vuyst L, Heyndrickx M, Pot , et al. Microbial characterization of probiot- ics–advisory report of the Working Group “8651 Probiot- ics” of the Belgian Superior Health Council (SHC). Mol Nutr Food Res 2013;57:1479-1504.
- US Pharmacopeia, Microbial Food Cultures ncluding Pro-
- Appendix XV, pag. 1709, First Supplement, FCC 8, December 2012. http://www.usp.org/sites/default/files/ usp_pdf/EN/fcc/appendix_xv-_microbial_food_cultures. pdf
- Indian Council of Medical Research Task ICMR-DBT guidelines for evaluation of probiotics in food. Indian J Med Res 2011;134:22-5; http://icmr.nic.in/guide/PROBIOT- ICS_GUIDELINES.pdf
- Besselink MG, van Santvoort HC, Buskens E, Boermeester MA, van Goor H, Timmerman HM, et ; Dutch Acute Pancreatitis Study Group. Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double- blind, placebo-controlled trial. Lancet 2008;371(9613):651-9. Erratum in: Lancet 2008 Apr 12;371(9620):1246.
- Kochan P, Chmielarczyk A, Szymaniak L, Brykczynski M, Galant K, Zych A, et Lactobacillus rhamnosus admin- istration causes sepsis in a cardiosurgical patient–is the time right to revise probiotic safety guidelines? Clin Microbiol Infect 2011;17(10):1589-92.
- Guarner F, Perdigon G, Corthier G, Salminen S, Koletzko B,
Morelli L. Should yoghurt cultures be considered probiotic? Br J Nutr 2005 Jun;93(6):783-6.
- EFSA Scientific Opinion on the substantiation of health claims related to Bifidobacterium animalis Lafti B94 (CBS118.529) and decreasing potentially pathogenic in- testinal microorganisms (ID 867) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. EFSA Journal 2009;7(9)
- Fiocchi A, Burks W, Bahna SL, Bielory L, Boyle RJ, Cocco R, et al; WAO Special Committee on Food Allergy and Nutri- tion. Clinical Use of Probiotics in Pediatric Allergy (CUPPA): A World Allergy Organization Position World Allergy Organ J 2012 Nov;5(11):148-67.
- Fiocchi A, Pawankar R, Cuello-Garcia C, Ahn K, Al-Hamma- di S, Agarwal A, et World Allergy Organization-McMas- ter University. Guidelines for Allergic Disease Prevention (GLAD-P): Probiotics. World Allergy Organ J 2015 Jan 27;8(1):4.
- Szajewska H, Guarino A, Hojsak I, Indrio F, Kolacek S, Shamir R, et ; European Society for Pediatric Gastroen- terology, Hepatology, and Nutrition. Use of probiotics for management of acute gastroenteritis: a position paper by the ESPGHAN Working Group for Probiotics and Prebiotics. J Pediatr Gastroenterol Nutr 2014;58(4):531-9.
- Didari T, Mozaffari S, Nikfar S, Abdollahi Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with meta-analysis. World J Gastroenterol 2015 Mar 14;21(10):3072-84.
- Korterink JJ, Ockeloen L, Benninga MA, Tabbers MM, Hilbink M, Deckers-KockenJM. Probiotics for childhood
functional gastrointestinal disorders: a systematic review and meta-analysis. Acta Paediatr 2014 Apr;103(4):365- 72.
- Guandalini Are probiotics or prebiotics useful in pediatric irritable bowel syndrome or inflammatory bowel disease? Front Med (Lausanne) 2014 Aug 28;1:23.
- Xu M, Wang J, Wang N, Sun F, Wang L, Liu The efficacy and safety of the probiotic bacterium Lactobacillus reuteri DSM 17938 for infantile colic: a meta-analysis of random- ized controlled trials. PLoS One 2015 Oct 28;10(10).
- Sung V, Hiscock H, Tang ML, Mensah FK, Nation ML, Satzke C, et Treating infant colic with the probiotic Lactobacillus reuteri: double blind, placebo controlled randomised trial. BMJ 2014 Apr 1;348:g2107.
- Hao Q, Dong BR, Wu Probiotics for preventing acute upper respiratory tract infections. Cochrane Database Syst Rev 2015 Feb 3;2:CD006895.
- Goldenberg JZ, Ma SS, Saxton JD, Martzen MR, Vandvik PO, Thorlund K, et Probiotics for the prevention of Clos- tridium difficile-associated diarrhea in adults and children. Cochrane Database Syst Rev 2013 May 31;5:CD006095.
- Johnston BC, Goldenberg JZ, Vandvik PO, Sun X, Guyatt GH. Probiotics for the prevention of pediatric antibiotic-as- sociated Cochrane Database Syst Rev 2011 Nov 9;(11):CD004827.
- New Zealand Ministry for Primary Industries, Global Regulatory Environment of Health Claims on Foods, MPI Technical Paper No: 2015/16; mpi.govt.nz/docu- ment-vault/9307
❚ Letture consigliate
Davidson LE, Fiorino AM, Snydman DR, Hibberd PL. Lacto- bacillus GG as an immune adjuvant for live-attenuated influenza vaccine in healthy adults: a randomized dou- ble-blind placebo-controlled trial. Eur J Clin Nutr 2011 Apr;65(4):501-7.
Jespersen L, Tarnow I, Eskesen D, Morberg CM, Michelsen B, Bügel S, et al. Effect of Lactobacillus paracasei subsp. paracasei, L. casei 431 on immune response to influ- enza vaccination and upper respiratory tract infections in healthy adult volunteers: a randomized, double-blind, placebo-controlled, parallel-group study. Am J Clin Nutr 2015 Jun;101(6):1188-96.
Osborn DA, Sinn JKH. Probiotics in infants for prevention of allergic disease and food hypersensitivity. Cochrane
Database of Systematic Reviews 2007, Issue 4. Art. No.: CD006475
Position Paper italiano sui Probiotici, 2010.
Rizzardini G, Eskesen D, Calder PC, Capetti A, Jespersen L, Clerici M. Evaluation of the immune benefits of two probiotic strains Bifidobacterium animalis ssp. lactis, BB-12® and Lactobacillus paracasei ssp. paracasei, L. casei 431® in an influenza vaccination model: a ran- domised, double-blind, placebo-controlled study. Br J Nutr 2012 Mar;107(6):876-84.
Schiffrin EJ, Rochat F, Link-Amster H, Aeschlimann JM, Don- net-Hughes A. Immunomodulation of human blood cells following the ingestion of lactic acid bacteria. J Dairy Sci 1995 Mar;78(3):491-7.





