Integratori alimentari per contrastare l’invecchiamento: di quali sostanze si ha più bisogno?
L’invecchiamento della popolazione è un fenomeno fisiologico progressivo che caratterizza oggi le società occidentali. L’Italia si trova al secondo posto nel mondo, dopo il Giappone, nella graduatoria dei Paesi con il maggior numero di soggetti anziani (il 21,7% della popolazione). Il rapporto annuale ISTAT del 2015 ha riportato che l’aspettativa di vita in Italia risulta raddoppiata rispetto agli inizi del 1900, quando la spettanza di vita per uomini e donne era di circa 43 anni; ad oggi (2015) le donne possono contare su un’aspettativa di vita di 84,7 anni e gli uomini di 80,1, ma di questi solo 73,6 e 69,7 anni sono rispettivamente anni di vita attiva, definiti Healty Adjusted Life Years (HALE); gli ultimi 9,3 anni per la donna e 7 anni per l’uomo sono Disability Adjusted Life Years (DALY)2. Questo fenomeno demografico si associa all’aumento nella popolazione di malattie cronico-degenerative, spesso associate alla disabilità3. La grande sfida della medicina di oggi è cercare di far coincidere l’attesa di vita con l’attesa di vita attiva.
Nel corso di tutta la vita, fattori genetici e fattori ambientali e la loro reciproca interazione diventano determinanti nell’influenzare la qualità delle prestazioni funzionali organiche, cognitive e psicologiche del soggetto anziano, cioè la cosiddetta longevity4. E proprio nel determinare la durata e la qualità della vita diventa prevalente l’azione dell’ambiente (dieta, stile di vita, attività lavorativa, ecc.) che incide per circa il 70%. Infatti un soggetto anziano può procedere verso il cosiddetto usual aging, spesso gravato da più malattie croniche, oppure verso un successful aging, cioè un anziano con prestazioni psico-fisiche superiori rispetto ai coetanei5, 6. Un’alimentazione adeguata, associata ad una costante e corretta attività fisica rappresentano sicuramente due fattori che possono incidere significativamente nel raggiungimento di un succesful aging. Anche l’assunzione di nutraceutici in ambito di prevenzione e terapia per quanto riguarda le patologie che più frequentemente caratterizzano l’invecchiamento, quali l’osteoporosi, le dislipidemie e la sarcopenia, può rappresentare un modo per il raggiungimento di un invecchiamento di successo
Nutraceutica e dislipidemia
L’iperlipidemia, risultante dalle anomalie dell’omeostasi dei lipidi, è un fattore di rischio per lo sviluppo di malattie cardiovascolari (CVD)7. È noto che l’aumento del colesterolo totale, e particolarmente di colesterolo LDL (LDL-C), è positivamente associato al rischio di CVD, mentre valori elevati di colesterolo HDL (HDL-C) sono inversamente correlati con il rischio di CVD [8], patologie che oggi sono la principale causa di morbilità e mortalità in tutto il mondo [9]. Secondo i dati ISSANMCO (Istituto Superiore di Sanità – Associazione Nazionale Medici Cardiologi Ospedalieri) circa il 35% dei soggetti adulti si trova in una situazione borderline o di ipercolesterolemia lieve o moderata (ovvero con valori di colesterolemia compresi tra 200 e 239 mg/dL). Tra gli anziani, il 24% degli uomini e il 39% delle donne sono in condizione di ipercolesterolemia conclamata, e il 36% degli uomini e il 38% delle donne presentano livelli borderline. L’approccio terapeutico per l’ipercolesterolemia moderata comprende una impostazione dietetica secondo le indicazioni del National Cholesterol Education Program, associata all’eventuale assunzione di specifici nutraceutici con potenziale attività ipocolesterolemizzante10.
Un recente Joint position statement11 della Società Italiana di Diabetologia e della Società Italiana per lo Studio dell’Aterosclerosi ha recentemente valutato l’effetto ipocolesterolemizzante di alcuni nutraceutici e ha concluso che tale effetto è supportato da un buon livello di evidenze scientifiche, come mostrato nella Tabella 1.

Pertanto, il loro uso può essere consigliato ad alcune categorie particolari di pazienti, come i soggetti anziani, come riportato in Tabella 2.
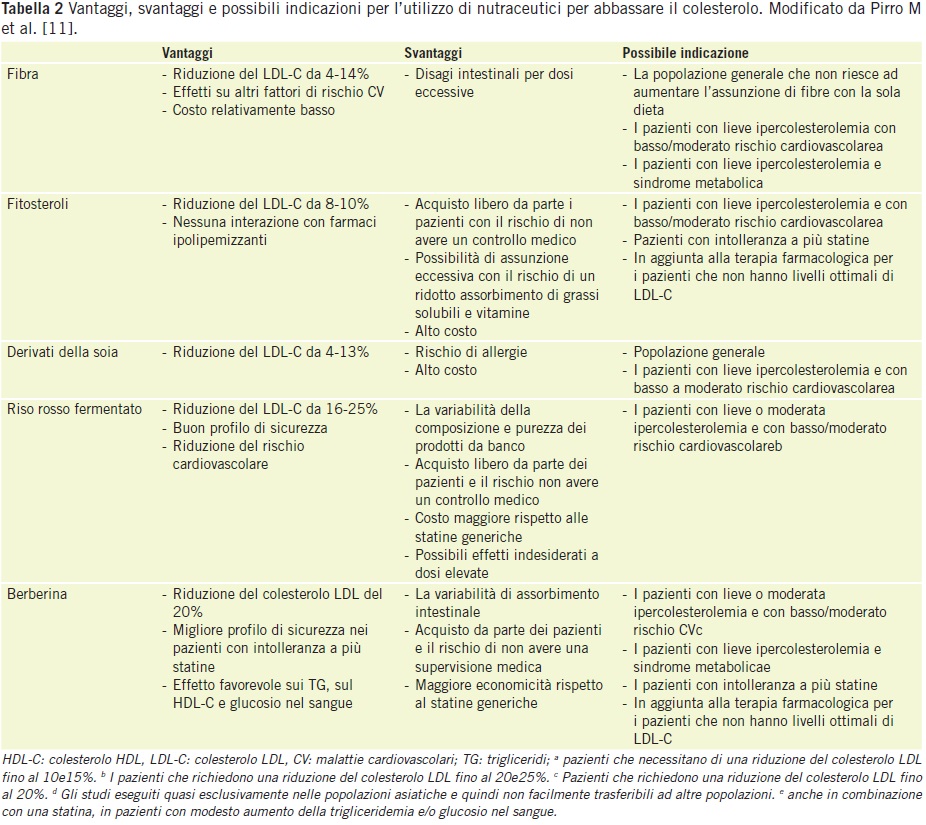
Nello specifico, per quanto riguarda la berberina, ci sono sufficienti evidenze che mostrano effetti ipocolesterolemizzanti significativi, ma gli studi d’intervento sono stati effettuati quasi esclusivamente sulle popolazioni asiatiche, rendendo questi risultati difficili da generalizzare ad altri gruppi etnici. I dati relativi agli effetti della soia sono conflittuali e hanno una bassa forza di raccomandazione, mentre l’evidenza scientifica è inconcludente per i policosanoli. Sono stati effettuati studi anche sulle diverse combinazioni di nutraceutici e ci sono prove a sostegno della sicurezza e dell’efficacia ipocolesterolemizzante di basse dosi di riso rosso fermentato/berberina/policosanoli/astaxantina/coenzima Q10/acidi grassi omega 3. Tuttavia, sulla base dei dati a disposizione, non vi è ancora dimostrazione di un effetto ipocolesterolemizzante dell’azione sinergica dei nutraceutici usati in queste combinazioni.
Nutraceutica e osteoporosi
L’assunzione di un’adeguata quantità di calcio e vitamina D rappresenta una realtà consolidata dal punto di vista scientifico, fondamentale per mantenere un’adeguata densità minerale ossea12. La letteratura scientifica ha individuato, grazie sia a studi epidemiologici che hanno messo in correlazione l’assunzione di un determinato nutriente con la densità minerale ossea, sia tramite studi di intervento, anche altri nutrienti (quali vitamina C, K, del gruppo B, magnesio, acidi grassi omega 3) e nutraceutici (isoflavoni, flavonoidi) che devono essere assunti in quantità adeguate per mantenere un’ottimale densità ossea. Inoltre, i modelli animali indicano che lo stress ossidativo è uno dei principali meccanismi della perdita di massa ossea e forza. L’invecchiamento e il conseguente aumento delle specie reattive dell’ossigeno influenzano notevolmente la generazione e la sopravvivenza di osteoclasti, osteoblasti e osteociti13. Pertanto, gli antiossidanti sono stati studiati nel loro ruolo di prevenire le malattie e promuovere la salute. Gli antiossidanti che possono riguardare la salute delle ossa sono vitamina A, vitamina E, vitamina C, carotenoidi e flavonoidi.
Vitamina C
Una significativa associazione, la quale è rimasta significativa dopo aggiustamento per fattori confondenti, è stata dimostrata tra l’assunzione di vitamina C e la densità minerale ossea (bone mineral density, BMD)14-16. La vitamina C è il coenzima richiesto nell’drossilazione della prolina e della lisina durante la sintesi del collagene negli osteoblasti17, 18. Ci sono 2 studi importanti nell’uomo sugli effetti della supplementazione di vitamina C sulla BMD. Morton et al.19 hanno studiato 994 donne in post-menopausa, di cui 277 assumevano regolarmente vitamina C (media 745 mg/ die) da più di 3 anni; queste presentavano un valore di BMD più alto rispetto a chi non la assumeva. Lo stesso risultato è stato riscontrato dallo studio di Leville et al.20. Per quanto riguarda gli studi di intervento con vitamina C, Ruiz Ramos et al.21 suggeriscono che la somministrazione di 1000 mg di acido ascorbico insieme con 400 IU di alfa-tocoferolo è utile per prevenire l’osteoporosi legata all’età in un campione di 90 soggetti anziani.
Vitamina K
Nel Framingham Offspring Study, Booth et al.22 hanno segnalato una significativa associazione positiva tra l’assunzione di vitamina K e la BMD dell’anca e della colonna vertebrale nelle donne. Inoltre, un deficit subclinico di vitamina K potrebbe contribuire allo sviluppo di osteoporosi23. Per quanto riguarda lo studio di intervento nell’uomo, Iwamoto et al.24 hanno dimostrato che un integratore di vitamina K2 sopprime la diminuzione di BMD vertebrale rispetto al gruppo non trattato. L’effetto delle vitamine K e D sulla BMD è stato confrontato con l’effetto di calcio e vitamina D25. I risultati di questo studio indicano che la somministrazione combinata di vitamina D3 e di vitamina K2, rispetto alla somministrazione di calcio, sembra essere utile nell’aumentare la densità minerale ossea della colonna lombare in donne in post-menopausa con osteoporosi.
Vitamine del gruppo B
Una maggiore assunzione di vitamina B6 (piridossina) con la dieta è risultata associata con una maggiore densità minerale ossea. Inoltre, lo stesso studio ha dimostrato una riduzione del rischio di frattura in relazione all’assunzione di piridossina alimentare indipendente dalla BMD26. La vitamina B6 è coinvolta come coenzima nel processo di assemblaggio del collagene nella matrice extracellulare. Masse, su un modello animale, ha dimostrato l’importanza di questo processo extracellulare per la forza delle ossa27. Un interessante studio clinico effettuato da Reynolds ha mostrato che la metà dei pazienti con fratture dell’anca erano carenti di vitamina B628. Studi in vitro hanno dimostrato che basse concentrazioni di vitamina B stimolano gli osteoclasti29. Per quanto riguarda le altre vitamine B (acido folico, vitamina B2 e vitamina B12), in questo contesto è importante ricordare il rapporto tra la carenza di queste vitamine e la presenza di iperomocisteinemia e di osteoporosi30. In effetti folati, vitamina B2 (riboflavina) e vitamina B12 possono influenzare la densità dell’osso, direttamente o con un effetto sui livelli plasmatici di omocisteina.
Magnesio, potassio, zinco
Un’associazione significativa, rimasta significativa dopo aggiustamento per molti dei principali fattori di confondimento, è stata trovata tra assunzione di potassio, magnesio, zinco, vitamina C e BMD14, 31.
Isoflavoni della soia
Molti studi affermano che non vi è alcun beneficio riguardo gli isoflavoni (proteine di soia) per quanto riguarda l’aumento della densità ossea o la diminuzione del turnover osseo nelle donne in post-menopausa, poiché un numero troppo alto di variabili non sono state considerate nei vari studi, come il tipo di dieta, gli anni di menopausa, la composizione del fitoestrogeni.
Flavonoidi
I flavonoidi, che si trovano in alimenti di origine vegetale, sono classificati come flavanoni, antocianine, flavan-3-oli, polimeri, flavonoli, flavoni e isoflavoni. In un recente studio di coorte su gemelli nel Regno Unito, una maggiore assunzione di flavonoidi totali è stata associata ad una maggiore densità minerale ossea della colonna vertebrale. L’assunzione di antociani e flavoni è positivamente associata alla BMD vertebrale e femorale32, 33. La quercetina è un membro della famiglia dei flavonoidi ed è un potente antiossidante. È stato dimostrato che la quercetina diminuisce la differenziazione delle cellule progenitrici degli osteoclasti e inibisce l’attività degli osteoclasti maturi in vitro. Inoltre, la quercetina potrebbe agire insieme alle proprietà alcalinizzanti della frutta per inibire gli osteoclasti e migliorare la densità minerale ossea34-36. Tuttavia, senza ulteriori dati, il consiglio sarebbe quello di assumere composti flavonoidi da frutta e verdura invece che da un supplemento.
Acidi grassi omega-3
Gli acidi grassi omega 3 possono influire sulla salute dello scheletro, non solo per la loro funzione antinfiammatoria, ma anche perché possono regolare in positivo l’assorbimento intestinale del calcio37. Un’associazione positiva è stata trovata tra l’assunzione nella dieta di acidi grassi omega-3 e la BMD in 78 uomini sani giovani38. L’assunzione di omega-3 è stata anche correlata positivamente con la BMD a livello dell’anca in 247 anziani39, 40 e con la colonna lombare e la BMD corporea totale in 554 donne anziane finlandesi41. Tuttavia, in una recente revisione sul potenziale beneficio degli acidi grassi omega-3 sulla salute dello scheletro, si è concluso che avviene solo in concomitanza alla somministrazione di calcio42. È anche possibile che un rapporto inferiore di omega-6 e omega-3 possa essere positivamente associato alla salute delle ossa43.
Sarcopenia e nutraceutica
La sarcopenia si verifica con l’aumentare dell’età ed è un importante componente nello sviluppo della fragilità 44. È una sindrome caratterizzata dalla perdita progressiva e generalizzata di massa muscolare scheletrica e della forza, con un rischio di eventi avversi come la disabilità fisica, la scarsa qualità della vita e la morte45. Nella maggior parte degli anziani, l’insorgenza della sarcopenia è multi-fattoriale. Le principali cause identificate sono di natura metabolica, infiammatoria, ormonale, neurologica, nutrizionale e funzionale. La dieta e l’esercizio fisico sono trattamenti preventivi e possono aiutare a preservare la mobilità negli anni successivi migliorando la qualità della vita46. L’approccio più razionale per ritardare la progressione della sarcopenia si basa sulla combinazione di una corretta alimentazione, eventualmente associata all’uso di integratori alimentari, e un programma di esercizio fisico regolare47. Le linee guida a cui fare riferimento per l’approccio nutrizionale sono delineate dal position paper del PROT-AGE Study group48, che riporta l’importanza dell’assunzione quotidiana di 1,2 g/proteine/kg peso per la prevenzione della sarcopenia e di 1,5 g/proteine/kg peso per la terapia, associati a 4 g di leucina con una somministrazione frazionata in 3 pasti costituiti da almeno 25 grammi di proteine ciascuno. Con l’avanzare dell’età si assiste ad un cambiamento nella composizione corporea, con aumento del tessuto adiposo che contribuisce ad elevare il tasso ematico di alcune citochine, in particolare tumor necrosis factor-alfa (TNF-á), interleuchina-1 e interleuchina-6, i cui livelli circolanti possono aumentare da 2 a 4 volte nel corso dell’invecchiamento49. Questo porta l’organismo di un anziano verso una situazione d’infiammazione cronica, definita inflammaging, la quale inibisce la sintesi proteica muscolare favorendo lo sviluppo della sarcopenia. È proprio sull’infiammazione e lo stress ossidativo che è possibile agire mediante l’assunzione di specifici nutraceutici.
Ad oggi, ci sono molti studi sugli animali e in vitro, ma gli studi sull’uomo, che valutano l’efficacia delle attività antinfiammatorie e antiossidanti di nutraceutici sul benessere del muscolo scheletrico, sono ancora molto pochi. I risultati disponibili suggeriscono che possono essere potenzialmente utili come integratori alimentari per prevenire la perdita di massa muscolare e la sua funzione i seguenti nutraceutici: la curcumina da Curcuma longa, gli alcaloidi e i lattoni steroidei da Withania somnifera (solanaceae), le catechine da Camellia sinensis, le proantocianidine di semi d’uva. Diversi studi hanno indagato i meccanismi con i quali la curcumina, un costituente di curcuma (Curcuma longa L.), esercita il suo effetto benefico sul muscolo50. Uno studio sperimentale ha dimostrato che la curcumina sopprime l’attivazione di NF-kB, un effetto di rilevanza critica per il sollievo, dal momento che NF-kB sembra essere coinvolto nella regolazione della proteolisi e dell’infiammazione nel muscolo50. Pertanto, l’inibizione di NF-kB da curcumina può comportare un effetto protettivo sul muscolo. Inoltre è stato suggerito che la curcumina può prevenire la perdita di massa muscolare in corso di sepsi ed endotossiemia e può stimolare la rigenerazione muscolare dopo una lesione traumatica50. Altri meccanismi potenzialmente responsabili delle proprietà anti-infiammatorie e antiossidanti della curcumina includono l’induzione della risposta heat-shock50, la riduzione nell’espressione dell’enzima proinfiammatorio cicloossigenasi-2 (COX-2) e la promozione della risposta antiossidante mediante attivazione del fattore di trascrizione Nrf251. Per quanto riguarda l’uso di Withania somnifera, la somministrazione di 50-750 mg due volte al giorno per 3 mesi52 ha determinato un miglioramento nella forza muscolare nell’uomo e anche l’integrazione con 350 mL di thè fortificato con 540 mg di catechine da Camellia sinesis ha indotto un miglioramento fisico positivo in donne anziane sarcopeniche giapponesi53. Infine, una ricerca clinica ha dimostrato come una supplementazione con semi d’uva (100-200 mg/die) sembri incrementare la massa muscolare e migliorare altre condizioni fisiche durante la menopausa54.

Bibliografia
[1] Rapporti ISTAT. Disponibile al sito: http://www.istat.it/it/anziani/popolazione-e-famiglie. Ultimo accesso 8 febbraio 2017.
[2] Murray CJL, Lopez AD. The global burden of disease: a comprehensive assessment of mortality and disability from diseases, injuries and risk
factors in 1990 and projected to 2020. Cambridge: Harvard University Press. 1996.
[3] Fried LP, Guralnik JM. Disability in older adults: evidence regarding significance, etiology and risk. J Am Geriatric Soc. 1997; 45: 92-100.
[4] Hayflick L. Origins of longevity. In: Warner HR, Butler RN, Sprott RL, Schneider EL, editors. Modern Biological Theories of aging. New York:
Raven Press. 1987; 21-34.
[5] Finch CE, Tanzi RE. Genetics of ageing. Science. 1997; 278: 407-11.
[6] Rowe JW, Kahn RL. Human Aging: usual and successfull. Science. 1987; 237: 143-9.
[7] Jain KS, Kathiravan MK, Somani RS, Shishoo CJ. The biology and chemistry of hyperlipidemia. Bioorganic and Medicinal Chemistry. 2007; 4: 4674-99.
[8] De Backer G, Ambrosioni E, Borch-Johnsen K et al. European guidelines on cardiovascular disease prevention in clinical practice: third joint
task force of European and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of eight
societies and by invited experts). European Journal of Cardiovascular Prevention and Rehabilitation. 2003; 4: S-S0.
[9] Murray CJL, Lopez AD. Global mortality, disability, and the contribution of risk factors: global burden of disease study. The Lancet. 1997;
349: 436-42.
[10] National Cholesterol Education Program (NCEP). Circulation. 1994; 89: 1333-445.
[11] Pirro M, Vetrani C, Bianchi C et al. Joint position statement on “Nutraceuticals for the treatment of hypercholesterolemia” of the Italian Society of
Diabetology (SID) and of the Italian Society for the Study of Arteriosclerosis (SISA). Nutrition, Metabolism & Cardiovascular Diseases. 2017; 27: 2-17.
[12] Bischoff-Ferrari HA, Willett WC, Wong JB et al. Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled
trials. JAMA. 2005; 293: 2257-64.
[13] Manolagas SC. From estrogen-centric to aging and oxidativestress: a revised perspective of the pathogenesis of osteoporosis. Endocr Rev.
2010; 31: 266-300.
[14] Ilich JZ, Brownbill RA, Tamborini L. Bone and nutrition in elderly women: protein, energy, and calcium as main determinants of bone mineral
density. Eur J Clin Nutr. 2003; 57: 554-65.
[15] New SA, Bolton-Smith C, Grubb DA, Reid DM. Nutritional influences on bone mineral density: a cross-sectional study in premenopausal
women. Am J Clin Nutr. 1997; 65: 1831-9.
[16] Hall SL, Greendale GA. The relation of dietary vitamin C intake to bone mineral density: results from the PEPI study. Calcif Tissue Int. 1998;
63: 183-9.
[17] Roughead ZK, Kunkel ME. Effect of diet on bone matrix constituents. J Am Coll Nutr. 1991; 10: 242-6.
[18] Franceschi RT. The role of ascorbic acid in mesenchymal differentiation. Nutr Rev. 1992; 50: 65-70.
[19] Morton DJ, Barrett-Connor EL, Schneider DL. Vitamin C supplement use and bone mineral density in postmenopausal women. J Bone Miner
Res. 2001; 16: 135-40
[20] Leveille SG, LaCroix AZ, Koepsell TD et al. Dietary vitamin C and bone mineral density in postmenopausal women in Washington State, USA.
J Epidemiol Community Health. 1997; 51: 479-85.
[21] Ruiz-Ramos M, Vargas LA, Fortoul Van der Goes TI et al. Supplementation of ascorbic acid and alpha-tocopherol is useful to preventing bone
loss linked to oxidative stress in elderly. J Nutr Health Aging. 2010; 14: 467-72.
[22] Booth SL, Broe KE, Gagnon DR et al. Vitamin K intake and bone mineral density in women and men. Am J Clin Nutr. 2003; 77: 512-6
[23] Weber P. The role of vitamins in the prevention of osteoporosis–a brief status report. Int J Vitam Nutr Res. 1999; 69: 194-7.
[24] Iwamoto I, Kosha S, Noguchi S et al. A longitudinal study of the effect of vitamin K2 on bone mineral density in postmenopausal women a
comparative study with vitamin D3 and estrogen-progestin therapy. Maturitas. 1999; 31: 161-4.
[25] Iwamoto J, Takeda T, Ichimura S. Effect of combined administration of vitamin D3 and vitamin K2 on bone mineral density of the lumbar spine
in postmenopausal women with osteoporosis. J Orthop Sci. 2000; 5: 546-51.
[26] Yazdanpanah N, Zillikens MC, Rivadeneira F et al. Effect of dietary B vitamins on BMD and risk of fracture in elderly men and women: the
Rotterdam study. Bone. 2007; 41: 987-94.
[27] Masse PG, Rimnac CM, Yamauchi M et al. Pyridoxine deficiency affects biomechanical properties of chick tibial bone. Bone. 1996; 18: 567-74.
[28] Reynolds T, Marshall PD, Brain AM. Hip fracture patients may be vitamin B6 deficient. Controlled study of serum pyridoxal-5’-phosphate.
Acta Orthop Scand. 1992; 63: 635-8.
[29] Herrmann M, Widmann T, Colaianni G at al. Increased osteoclast activity in the presence of increased homocysteine concentrations. Clin Chem.
2005; 51: 2348-53.
[30] Herrmann M, Peter Schmidt J, Umanskaya N et al. The role of hyperhomocysteinemia as well as folate, vitamin B(6) and B(12) deficiencies
in osteoporosis: a systematic review. Clin Chem Lab Med. 2007; 45: 1621-32.
[31] Tranquilli AL, Lucino E, Garzetti GG, Romanini C. Calcium, phosphorus and magnesium intakes correlate with bone mineral content in postmenopausal
women. Gynecol Endocrinol. 1994; 8: 55-8.
[32] Welch A, Macgregor A, Jennings A et al. Habitual flavonoid intakes are positively associated with bone mineral density in women. J Bone Miner
Res. 2012; 27: 1872-8.
[33] Hardcastle AC, Aucott L, Reid DM, Macdonald HM. Associations between dietary flavonoid intakes and bone health in a Scottish population.
J Bone Miner Res. 2011; 26: 941-7.
[34] Wattel A, Kamel S, Prouillet C, Petit et al. Flavonoid quercetin decreases osteoclastic differentiation induced by RANKL via a mechanism
involving NF kappa B and AP-1. J Cell Biochem. 2004; 92: 285-95.
[35] Woo JT, Nakagawa H, Notoya M et al. Quercetin suppresses bone resorption by inhibiting the differentiation and activation of osteoclasts. Biol
Pharm Bull. 2004; 27: 504-9.
[36] Wattel A, Kamel S, Mentaverri R et al. Potent inhibitory effect of naturally occurring flavonoids quercetin and kaempferol on in vitro osteoclastic
bone resorption. Biochem Pharmacol. 2003; 65: 35-42, 56.
[37] Hay AW, Hassam AG, Crawford MA et al. Essential fatty acid restriction inhibits vitamin D-dependent calcium absorption. Lipids. 1980; 15: 251-4.
[38] Hogstrom M, Nordstrom P, Nordstrom A. n-3 Fatty acids are positively associated with peak bone mineral density and bone accrual in healthy
men: the NO2 Study. Am J Clin Nutr. 2007; 85: 803-7.
[39] Rousseau JH, Kleppinger A, Kenny AM. Self-reported dietary intake of omega-3 fatty acids and association with bone and lower extremity
function. J Am Geriatr Soc. 2009; 57: 1781-8.
[40] Salari P, Rezaie A, Larijani B, Abdollahi M. A systematic review of the impact of n-3 fatty acids in bone health and osteoporosis. Med Sci
Monit. 2008; 14: 37-44.
[41] Jarvinen R, Tuppurainen M, Erkkila AT et al. Associations of dietary polyunsaturated fatty acids with bone mineral density in elderly women.
Eur J Clin Nutr. 2012; 66: 496-503.
[42] Orchard TS, Pan X, Cheek F, Ing SW, Jackson RD. A systematic review of omega-3 fatty acids and osteoporosis. Br J Nutr. 2012; 107 (Suppl.
2): S253-S260.
[43] Weiss LA, Barrett-Connor E, von Muhlen D. Ratio of n-6 to n-3 fatty acids and bone mineral density in older adults: the Rancho Bernardo Study.
Am J Clin Nutr. 2005; 81: 934-8.
[44] Rolland Y, Czerwinski S, Abellan Van Kan G et al. Sarcopenia: its assessment, etiology, pathogenesis, consequences and future perspectives.
The Journal of Nutrition Health and Aging. 2008; 7: 433-50.
[45] Cruz-Jentoft AJ, Baeyens JP, Bauer JM et al. European working group on sarcopenia in older people. Sarcopenia: European consensus on definition
and diagnosis: report of the European working group on sarcopenia in older people. Age and Ageing. 2010; 4: 412-23.
[46] McGregor RA, Cameron-Smith D, and Poppitt SD. It is notjust muscle mass: a review of muscle quality, composition and metabolism during
ageing as determinants of muscle function and mobility in later life. Longevity & Healthspan. 2014; 1: article 9.
[47] Rondanelli M, Faliva M, Monteferrario F et al. Novel insights on nutrient management of sarcopenia in elderly. BioMed Research International
2015. Article ID 524948, pp. 14.
[48] Bauer J, Biolo G, Cederholm T et al. Evidence-based recommendations for optimal dietary protein intake in older people: a position paper from
the PROT-AGE Study Group. J Am Med Dir Assoc. 2013; 14: 542-59.
[49] Krabbe KS, Pedersen M, Bruunsgaard H. Inflammatory mediators in the elderly. Exp Gerontol. 2004; 39: 687-99.
[50] Alamdari N, O’Neal P, Hasselgren PO. Curcumin and muscle wasting-a new role for an old drug? Nutrition. 2009; 2: 125-9.
[51] Shehzad A, Lee YS Molecular mechanisms of curcumin action: signal transduction. BioFactors 2013; 1: 27-36.
[52] Mishra SK, Trikamji B. A clinical trial with Withania somnifera (Solanaceae) extract in the management of sarcopenia. Signpost Open Access
Journal of Organic and Biomolecular Chemistry. 2013; 1: 187-94.
[53] Kim H, Suzuki T, Saito K et al. Effects of exercise and tea catechins on muscle mass, strength and walking ability in community-dwelling
elderly Japanese sarcopenic women: a randomized controlled trial. Geriatrics & Gerontology International. 2013; 2: 458-65.
[54] Terauchi M, Horiguchi N, Kajiyama A et al. Effects of grape seed proanthocyanidin extract on menopausal symptoms, body composition, and
cardiovascular parameters in middle-aged women: a randomized, double-blind, placebo-controlled pilot study. Menopause. 2014; 9: 990-6






